实验室里制取的气体常常带有酸雾、水蒸气或其它杂质气体,要得到纯净的气体就必须进行气体的干燥和净化。
一、气体的干燥
在中学实验室制备的气体,根据它们水溶液的酸碱性,可以分为三种类型:
酸性气体:SO2、CO2、Cl2、HCl、H2S、NO2;
碱性气体:NH3;
中性气体:H2、O2、CH4、C2H2(乙炔)、CO、NO、C2H4(乙烯)。
根据干燥剂的酸碱性,也可以分为三种类型:
酸性干燥剂 如浓H2SO4、P2 O5等
碱性干燥剂 如碱石灰、CaO
中性干燥剂 如无水CuSO4、无水CaCl2
选择干燥剂的一般方法:
选择的干燥剂和净化剂一定要与被净化、被干燥的气体本身不反应,而只能与水蒸汽或杂质气体反应。因此,根据上面所列的干燥剂和常见的气体,在选择时,最重要的规律是:
⒈ 酸性干燥剂(如浓H2SO4、P2 O5等)一般只能用于干燥酸性或中性的气体,因为酸性的干燥剂易和碱性气体发生反应。例如:
2NH3 H2SO4=(NH4)2SO4。
同理,碱性干燥剂也不能干燥酸性气体。
⒉ 中性干燥剂(如无水CuSO4、无水CaCl2)一般对酸性、碱性、中性气体都能适用,但氯化钙不能用来干燥氨气。因为无水氯化钙能与氨气反应:
CaCl2 8NH3=CaCl2·8NH3。
⒊ 具有较强氧化性的浓硫酸,不能干燥具有强还原性的气体。如浓H2SO4不能干燥H2S气体。但浓H2SO4能干燥H2、CO这类还原性气体,因H2、CO的还原性在高温下才表现得更强。
二、气体的净化
气体净化的一般原理
由于各种气体具有不同的性质,因此,选择的净化剂也就有所不同,必须根据气体的性质和净化剂的性质来确定。一般应把握住净化剂能有效地与杂质气体反应,且反应易于进行,反应后又不会产生新的杂质气体;如果反应去掉杂质后还生成了我们所需要的气体,那就更好。例如:
欲除去CO2中混有的HCl气体,常用NaHCO3溶液作净化剂,因为
HCl NaHCO3=NaCl H2O CO2↑,
反应后即除去了HCl,还生成了CO2,这是两全齐美的好事,当然是很好的方法了。
选择净化剂的一般方法
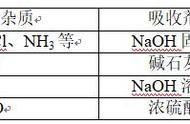
(1)易溶于水的杂质可用水吸收;
(2)酸性杂质可用碱性物质吸收;
(3)碱性杂质可用酸性物质吸收;
(4)水分可用干燥剂吸收;
(5)具氧化性或还原性的杂质可用还原剂或氧化剂除去;
(6)能与杂质反应生成沉淀或可溶性的物质,也可用作净化剂。
例如:
H2(HCl)(括号内为杂质气体),用水或NaOH吸收;
CO2(SO2)用饱和NaHCO3 溶液吸收;
CO(CO2)用澄清石灰水吸收;
Cl2(HCl)用饱和食盐水吸收;
CO2(O2)用加热的铜粉(或铜网)除去;
CO2(CO或H2)用加热的CuO或Fe2O3 粉末除去,等等。
气体干燥、净化的装置
气体的干燥常用干燥塔(图1)或干燥管(图3),气体的
净化装置常用洗气瓶(图2)或用广口瓶(也可用锥形瓶、大
试管、平底烧瓶等)组装的洗气瓶(见图4)。

气体干燥、净化的顺序
一般采用先净化后干燥的顺序,且将干燥操作尽量放在最
后一步,或者放在某一特定装置前(如实验装置或收集装置),
这样可以收到比较好的效果。
例:要除掉二氧化碳气中混有的水蒸气和氯化氢气体,应使该气体依次通过下图中的哪些装置?请将导管口的标号填入下面的括号内,(下列装置不要求全部使用)混有H2O(气)和HCl的CO2→(),由()→(),由()→得纯净的二氧化碳。
(答:8,7,4,3)