在酸溶液如盐酸中存在着三种微粒:H 、CI-和水分子,同样在碱溶液如NaOH溶液中也存在着三种微粒:Na 、OH-和水分子。可以运用对比实验的方法探究酸和碱溶液的化学性质是溶液中的何种微粒表现出来的。

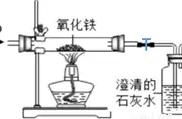
例3某化学实验小组欲探究盐酸、氢氧化钙的化学性质,取8支试管分别用A~H编号后,做如下实验。

(1)实验中观察到有气泡出现的试管是(填编号,下同),有沉淀生成的试管是(2)写出实验中无明显现象的试管中发生的化学方程式:
(3)实验后某试管中为红色溶液,当向其中加入过量的,溶液变为蓝色。由此推断,该试管中最初盛有的物质是
(4)实验后某试管的底部有白色固体,过滤后向滤液中滴加盐酸,一段时间后有气泡冒出,则该滤液中的溶质是

(解析)(1)铁与盐酸反应生成氯化亚铁和氢气;碳酸钠与盐酸反应生成氯化钠、水、二氧化碳,所以有气泡出现的试管是B和D;碳酸钠与澄清石灰水反应生成碳酸钙沉淀和氢氧化钠,二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水,所以有沉淀生成的试管是G和H
(2)澄清石灰水与盐酸反应生成氯化钙和水,反应过程中无明显现象。
(3)在A试管中盛有紫色石蕊溶液,加入盐酸后,显酸性,酸能使紫色石蕊溶液变红色,再向其中加入氢氧化钠溶液,当过量的氢氧化钠把盐酸反应完后,溶液显碱性,碱能使紫色石蕊溶液变蓝色。
(4)实验后某试管的底部有白色固体,即有白色沉淀生成,有沉淀生成的试管只有G和H;过滤后向滤液中滴加盐酸,一段时间后有气泡冒出,说明滤液中含有碳酸根离子,所以该试管为G;G中碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,所以滤液中一定含有氢氧化钠,又因为碳酸钠过量,所以滤液中还含有碳酸钠。

(答案)(1)BDGH(2)Ca(OH)2 2HCl=CaCl2 2H2O(3)NaOH溶液(或其他碱溶液)紫色石蕊溶液(4)NaOH和Na2CO3

本文由初中化学大师原创,欢迎关注,一起涨知识!
允许非盈利性引用,并请注明出处:“转载自初中化学大师”字样,以尊重作者的劳动成果。版权归原作/译者所有。未经允许,对非法转载者,保留采用法律手段追究的权利。