绪论
一、1-20号元素名称及符号:(书写原则:一大二小)
氢 氦 锂 铍 硼, 碳 氮 氧 氟 氖,
H He Li Be B, C N O F Ne ,
钠 镁 铝 硅 磷, 硫 氯 氩 钾 钙 。
Na Mg Al Si P , S Cl Ar K Ca 。
另外10种常考元素:
锰 铁 铜 锌 银 钡 铂 金 汞 碘
Mn Fe Cu Zn Ag Ba Pt Au Hg I
二.常考仪器
镊子、药匙、坩埚钳、漏斗、长颈漏斗、分液漏斗、酒精灯、试管、集气瓶、水槽 、天平、砝码、游码、活性炭(不是碳)
三、重要的化学反应文字表达式及现象(描述实验现象时,不能说出生成物的名称)物质燃烧实验现象的描述:一般为一光、二热、三生成。
1、铁在氧气中燃烧:
文字表达式 :铁 氧气 四氧化三铁
Fe O2 Fe3O4
现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
2、镁在空气中燃烧:
文字表达式 :镁 氧气 氧化镁
Mg O2 MgO
现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末
3、铝在空气中燃烧:
文字表达式 :铝 氧气 三氧化二铝(氧化铝)
Al O2 Al2O3
现象:发出耀眼的白光,放热,有白色固体生成。
4、碳在氧气中充分燃烧:
文字表达式 :碳 氧气 二氧化碳
C O2 CO2
现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊
5、硫粉在空气中燃烧:
文字表达式 :硫 氧气 二氧化硫
S O2 SO2
现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧
(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体
6、红(白)磷在空气中燃烧:
文字表达式 :红磷 氧气 五氧化二磷
P O2 P2O5
现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、氢气中空气中燃烧:
文字表达式 :氢气 氧气 → 水
H2 O2 H2O
现象: 淡蓝火焰、放热、
8、蜡烛在空气中燃烧
文字表达式 :石蜡 氧气 水 二氧化碳
O2 H2O CO2
现象:在氧气中燃烧发出白光,在空气中燃烧发黄光,集气瓶的内壁有水珠出现,并生成能使澄清的石灰水变浑浊的气体。

9、实验室制氧气:
① 高锰酸钾 锰酸钾 二氧化锰 氧气
KMnO4 K2MnO4 MnO2 O2
② 氯酸钾 氯化钾 氧气
KClO3 KCl O2
③ 过氧化氢 水 氧气
H2O2 H2O O2
第一单元 走进化学世界
一、物质的变化和性质
1. 化学是一门研究物质的组成、结构、性质以及变化规律的自然科学。
2.物理变化与物理性质
【物理变化】
(1)定义:没有生成其它物质的变化
(2)特征:物质的形态发生了变化
(3)形式:物质固液气三种状态的改变,破碎、扩散、溶解、蒸发、凝固、熔化、升华、吸附、干燥等
【物理性质】不需要发生化学变化就表现出来的性质。
包括: 颜色、状态、气味、熔点、沸点、溶解性、挥发性、导电性、密度、硬度等。
3.化学变化与化学性质
【化学变化】
(1)定义:变化时都生成了其他物质
(2)特征:生成了其它物质
(3)常伴随的现象:发光、放热、变色、变味、变质、放出气体、生成沉淀、生锈等。
【化学性质】通过化学变化表现出来的性质。
包括:可燃性、助燃性、氧化性、还原性、毒性、酸碱性、热稳定性等。
4、物理变化与化学变化的联系和区别
物理变化与化学变化的本质区别是:是否有新物质生成。
化学变化中 一定 伴随物理变化物理变化中 一定不 伴随化学变化
二、走进化学实验室
1、药品取用的基本原则。
⑴实验室取用药品要做到"三不":不能用手接触药品;不要鼻孔凑到容器口去闻药品的气味;不能尝任何药品的味道。
⑵取用药品注意节约:取用药品应严格按规定用量。若无说明,应取最少量,即:液体取1~2mL;固体只需盖满试管底部。
⑶用剩的药品要做到"三不":既不能放回原瓶,也不要随意丢弃,更不能拿出实验室,要放在指定的容器里。
2.固体药品的取用
⑴取用固体药品的仪器:一般用药匙;块状固体可用镊子夹取。
⑵取用小颗粒或粉末状药品,用药匙或纸槽按"一斜、二送、三直立"的方法送入玻璃容器;取用块状或密度大的金属,用镊子按"一横、二放、三慢竖"的方法送入玻璃容器。

3、液体药品的取用
⑴取用少量液体,可用胶头滴管。滴加到另一容器中的方法是将滴管悬空放在容器口正上方,滴管不要接触烧杯等容器壁,取液后的滴管不能倒放、乱放或平放。
⑵从细口瓶倒出液体药品时,先把瓶塞倒放在桌面上,以免沾污瓶塞,污染药液;倾倒液体时,应使标签向着手心,以防瓶口残留的药液流下腐蚀标签;瓶口紧靠试管口或仪器口,以免药液流出。倒完药液后立即盖紧瓶塞,以免药液挥发或吸收杂质。
⑶取用一定量的液体药品,常用量筒量取。量液时,量筒必须放平,倒入液体到接近要求的刻度,再用滴管逐滴滴入量筒至刻度线。读数时,视线与量筒内液体的凹液面最低处保持水平。
注意:俯视则读数偏大,仰视则读数偏小。
4. 物质的加热
(1)酒精灯的使用
①酒精灯的火焰分外焰、内焰、焰心三部分,其中外焰温度最高,因此,加热时应用外焰部分加热;酒精灯内的酒精不超过酒精灯容积的2/3;绝对禁止向燃着的酒精灯内添加酒精;绝对禁止用一只酒精灯引燃另一只酒精灯;使用完毕,必须用灯帽盖灭,不可用嘴吹灭。
②可以直接加热的仪器有:试管、蒸发皿、燃烧匙、坩埚等;可以加热但必须垫上石棉网的仪器有:烧杯、烧瓶等;不能加热的仪器有:量筒、集气瓶、漏斗、水槽等。
(2))给物质加热:加热玻璃仪器前应把仪器外壁擦干,以免使仪器炸裂;给试管里药品加热时,应先使试管均匀受热——预热,然后对准药品部位加热。给液体加热,试管与桌面约成45度角,且试管内液体不能超过试管容积的1/3,试管口不准对着有人的地方。
注意:给试管里固体加热时,试管口一般应略向下倾斜,以冷凝水或生成水倒流,使试管炸裂。
5.仪器的洗涤
玻璃仪器洗涤干净的标准:玻璃仪器内壁附着的水既不聚成水滴,也不成股流下。
6.近代化学理论的建立
⒈原子、分子理论:由道尔顿(英国人)、阿伏加德罗(意大利)建立了原子—分子理论。
⒉元素周期律、元素周期表:由门捷列夫(俄国人)发现。
7.两个重要实验
(1)蜡烛及其燃烧的探究
(2)对人体吸入的空气和呼出的气体的探究
第二单元 空气 氧气
一、空气
1.空气的成分
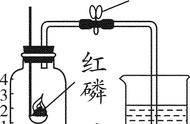
★2.探究空气中氧气的含量。
用实验证明空气中氧气体积约占1/5,氮气约占4/5 。