今天分享一下有关化学实验大题的综合知识预计两天之内讲完,这份资料比较适合那些复习过程不扎实,知识点仍有欠缺的同学,希望能帮助大家能把实验题搞定。
迷茫不可怕,说明你还在向前走。失败不可怕,只要你还能爬起来。可怕的是你安于现状!
一、气体的制取、净化和除杂
初中化学中的实验组合题一般以氧气、氢气和二氧化碳三大气体的制取和性质实验或迁移应用其原理和性质的实验为主线,将许多仪器连接起来形成完整的实验装置图,再根据要求进行实验。
1. 气体制取的仪器组合顺序
制备纯净干燥气体的步骤是:
实验仪器组装公式:气体发生装置→除杂质装置→干燥装置→气体收集装置→尾气处理
⑴ 制气装置的选择:主要考虑所需药品的状态和反应条件
⑵ 集气装置的选择:主要考虑气体的溶解性和气体的密度
⑶ 除杂质的试剂和干燥剂的选择:实验室制取的气体常常有酸雾或水份。
酸雾可用水、氢氧化钠溶液、澄清的石灰水或饱和碳酸钠(碳酸氢钠)溶液除去,
水份可用干燥剂如:浓硫酸(酸性)、碱石灰(碱性)、固体氢氧化钠(碱性)、氧化钙(碱性)、五氧化二磷(酸性)、无水氯化钙(中性)、无水硫酸铜(中性)等除去
(1)酸性干燥剂(浓硫酸)不能干燥碱性气体如氨气;
(2)碱性干燥剂(NaOH )不能干燥酸性气体如:二氧化硫、二氧化碳、、氯化氢等
气体除杂的方法:1. 水吸收法:易溶于水的气体杂质用水吸收。(如HCl)
2. 酸碱吸收法:酸性气体杂质用碱性试剂吸收。(如氢氧化钠溶液吸收CO2、HCl。)
3. 沉淀法:将杂质气体转变为沉淀除去。(如用澄清石灰水除CO2)
4. 固化法:将杂质气体与固体试剂反应生成固体而除去。(如除去O2用灼热的氧化铜)
5. 转纯法:将杂质转化为所需气体。(如除去CO中的CO2,可将气体通过炽热的炭粉)
气体除杂的原则:不减少被净化气体的质量,不引进新的杂质。
气体除杂的注意事项:
1. 选择除杂试剂:一般只能跟杂质起反应,而不能与被净化的气体反应。
2. 除杂务尽:选择除杂试剂要注意反应进行的程度。(如除去CO2时用氢氧化钠溶液比用澄清石灰水要好。因为氢氧化钠的溶解度比氢氧化钙要大很多,因此其溶质质量分数较大。)
3. 有许多杂质要除去时,要注意除杂的顺序。一般来说,杂质中有许多酸性杂质时,先除酸性较强的杂质;而水蒸气要放在最后除去
除去杂质和干燥的装置一般用洗气瓶或干燥管。在洗气瓶中导气管一般是长进短出,在干燥管中一般是大进小出。除杂和干燥一般是先除杂后干燥。
4. 处理装置:一般有三种,一是用溶液吸收;二是点燃尾气;三是回收。
例:
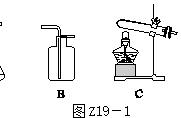
下图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器.试根据题目要求,回答下列问题:(设过程中所有发生的反应都恰好完全进行).

装置连接图
(1)若要制备纯净干燥的二氧化碳气体,仪器的连接顺序为 ______,装置A中所发生反应的化学方程式为_____________________________________ .
(2)生铁和钢都是铁的重要合金.某化学研究小组的同学要利用过氧化氢溶液和二氧化锰制备干燥、纯净的氧气并证明某生铁样品中含有碳元素并测定其含碳量,仪器连接顺序为:A→E→C→D1→B→D2.(已知D1、D2为2个澄清石灰水洗气瓶)
①装置A中所发生反应的化学方程式为__________________________________________ .
②其中装置E的作用是_____________________ .
③仪器D1中的现象是______________________ .
④请写出装置B中所发生反应的化学方程式_______________________________________ .
⑤现取Wg该生铁样品在纯氧中燃烧,当整套装置内的化学反应均完全进行后,经测量仪器D1增重m1g,仪器B增重m2g,仪器D2质量没有变化,则该试样中含碳元素的质量为______ 克(计算结果可为分数形式).
解答:解:(1)实验室通常用稀盐酸与大理石反应制取二氧化碳,反应物的状态是固态和液态,反应条件是常温,应选固-液不加热型的发生装置;二氧化碳的密度比空气大,能溶于水,只能用排水法收集;因为要收集到干燥的二氧化碳,所以应在收集装置前面加一个干燥装置,浓硫酸具有吸水性,可用来干燥二氧化碳,所以仪器的连接顺序为:A→E→F;碳酸钙和盐酸反应生成氯化钙、水和二氧化碳.
(2)①过氧化氢以二氧化锰为催化剂生成水和氧气.
②浓硫酸具有吸水性,可以吸收氧气中的水蒸汽.
③生铁中的碳和氧气反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊.
④二氧化碳和氢氧化钠反应生成碳酸钠和水.
⑤碳元素的质量=(m1g m2g)×1244=3(m1 m2)11g
故答案为:(1)A→E→F;CaCO3 2HCl═CaCl2 H2O CO2↑
(2)①2H2O2 MnO2 .
2H2O O2↑;②吸收氧气中的水蒸气(或干燥作用);③澄清石灰水变浑浊;④CO2 2NaOH=Na2CO3 H2O;⑤3(m1 m2)11
点评:二氧化碳和氢氧化钙、氢氧化钠都会发生反应,检验二氧化碳时一般用澄清的石灰水,因为二氧化碳和氢氧化钙反应有白色沉淀生成,而二氧化碳和氢氧化钠反应无明显现象;吸收二氧化碳时最好用氢氧化钠溶液,因为氢氧化钠极易溶于水,氢氧化钙微溶于水,等量的两种溶液中氢氧化钠溶液吸收的二氧化碳要多.
2. 制取气体的操作顺序
要制取气体需要经过仪器连接、气密性检查、装入药品、仪器拆洗等步骤。
3、氧气、氢气和二氧化碳的实验室制法和收集

参考表格
4、实验室制取三大气体中常见的要除的杂质:
(1)制O2要除的杂质:水蒸气(H2O)
(2)用盐酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用稀硫酸没此杂质)
(3)制CO2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl)
除水蒸气的试剂:浓流酸、CaCl2固体、碱石灰(主要成份是NaOH和CaO)、生石灰(主要是CaO)、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)等
除HCl气体的试剂:AgNO3溶液(并可检验出杂质中有无HCl)、澄清石灰水、NaOH溶液(或固体)、KOH溶液(或固体) [生石灰、碱石灰也可以跟HCl气体反应]
5、实验用到的气体要求是比较纯净,除去常见杂质具体方法:
① 除水蒸气可用:浓流酸、CaCl2固体、碱石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)、生石灰等
② 除CO2可用:澄清石灰水(可检验出杂质中有无CO2)、NaOH溶液、KOH溶液、碱石灰等
③ 除HCl气体可用:AgNO3溶液(可检验出杂质中有无HCl)、石灰水、NaOH溶液、KOH溶液
除气体杂质的原则:用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或者生成新的杂质。

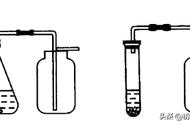
CO2收集除杂装置