实验: 二氧化碳的实验室制取


命题要点:
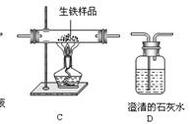
1.实验药品:大理石(或石灰石)与稀盐酸
【特别提醒】药品的选择
(1)能否用浓盐酸代替稀盐酸,请说明理由。
不能,因为浓盐酸具有挥发性,会使收集的CO2气体不纯。
(2)能否用稀硫酸代替稀盐酸,请说明理由。
不能,因为稀硫酸与大理石或石灰石反应生成的硫酸钙微溶于水,覆盖在大理石或石灰石表面,阻止了CaCO3与酸的接触,使反应不能持续进行。
(3)能否用碳酸钠或碳酸钾代替大理石或石灰石,请说明理由。
不能,因为碳酸钠或碳酸钾与稀盐酸反应速率过快,不利于CO2的收集。
2.反应原理:CaCO3+2HCl=== CaCl2+CO2↑+H2O。
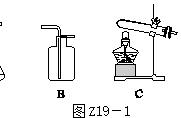
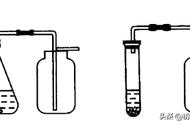
3.实验装置
(1)发生装置

说明:①A装置的优点安装简单,容易操作;
②B装置中长颈漏斗末端应伸入液面以下,以防生成的气体从长颈漏斗逸出_;
③C装置相对B装置的优点是可控制反应速率;
④D装置的优点:可随时控制反应的发生与停止。
a.控制反应发生的原理:打开弹簧夹,液体与固体接触反应发生;
b.控制反应停止的原理:关闭弹簧夹,生成的气体使装置内压强增大,把液体压入长颈漏斗(或多孔隔板以下),使固体和液体分离,反应停止。
(2)收集装置