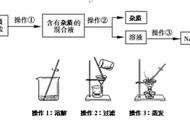
【实验结论】除去难溶性杂质得到的精盐不是纯净物。
参考答案与解析
1. D 解析:用托盘天平称取15.6g氯化钠,数据合理;pH大约到整数,用pH试纸测得溶液的pH为3.52,所以数据不合理;量取液体时,选用的量筒量程不能太大,且量筒不估读,直接读到分度值那位就好,10mL量筒分度位是0.1,用10mL量筒量取某溶液6.6mL,数据合理;普通温度计的读数不可能精确到0.01,故用普通温度计测得某液体温度为25.62℃,数据不合理;故选D。
2. B 解析:A. 瓶塞要倒放,A操作不正确;B. 往试管中加粉末状药品试管要平放,用药匙或纸槽将药品送往试管底部,然后竖起试管,最后弹一弹试管防止药品粘在试管内壁上,B操作正确;C. 给试管中的胆矾加热试管口要略向下倾斜,防止冷凝水倒流使试管炸裂,C操作不正确;D. 熄灭酒精灯要用灯帽盖灭,D操作不正确;故选B。
3. D 解析:A. 稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,一定不能把水注入浓硫酸中,故图中所示操作错误;B. 给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的,大拇指不能放在短柄上,图中液体超过试管容积的、没用外焰,故图中所示操作错误;C. 用pH试纸测定未知溶液的pH时,正确的操作方法为:用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH。不能将pH试纸伸入待测液中,以免污染试剂,故图中所示操作错误;D. 检查装置气密性的方法:把导管的一端浸没在水里,双手紧握容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确;故选D。
4. C 解析:在量筒制作过程中,已经将附着在筒壁上的残留部分造成的误差消除,也就是说,倒出来的量和眼睛观察刻度的数量是一样的;故A说法错误。量筒量液时要注意量程的选择,应选择略大于量取液体体积的量程,选取的量程太大,会因刻度不精确而使量取的液体体积不准确,选取的量程太小,多次称量会有误差。用量筒量取15mL蒸馏水,应选择略大于15mL的量程。用10mL的量筒需要2次量取,会有误差,所以应选择20mL的量筒;故B说法错误。量程为10mL的量筒的最小刻度值是1,故C说法正确。不同的量筒其分度值不同:如0.1、0.2、1等;故D错。故选C。
5. C 解析:称量时药品和砝码放反了,称得固体质量偏小,所配溶液溶质质量分数偏小,故A错;称取氯化钠的质量为50g×5%=2.5g,溶质质量分数不变,故B错误;量取溶剂时,俯视量筒读数,看到的读数偏大,但量取的液体实际体积偏小,所以溶剂少了,溶质质量分数就偏大,故C正确;配制好的溶液倒入试剂瓶时有部分溅出,溶质质量分数是不变的,因为溶液是均一的,故D错。综上所述,选C。
6. C 解析:甲实验的步骤是①④⑤,其中去除杂质的关键一步是过滤,故A不正确;甲实验在溶解、蒸发中玻璃棒的作用是用来搅拌的,在过滤时玻璃棒的作用是引流,故B不正确;根据图示数据由溶质质量分数的计算公式可知所得溶液的溶质质量分数为10.6%,导致配制的溶液浓度偏小,故C正确;乙实验中,若①所用烧杯刚刚用清水洗过,会有少量的水进入溶液,由溶质质量分数的计算公式可知,会导致配制的溶液浓度偏小。故D不正确。综上所述,选C。
7. (1)玻璃棒 (2)药品和砝码的位置放反了,砝码应放在右边,氯化钠应放在左边 12.0 (3)18.0% 12.8%
(4)12.0% (5)26.5%
解析:(1)该图表示配制溶液全过程需用的所用仪器,称量使用托盘天平、量筒,溶解时还会用到烧杯和玻璃棒,缺少:玻璃棒和药匙,其中玻璃棒是玻璃仪器;(2)由图示可以看出托盘天平的使用错误,物、码放反了;由正确称量:"物质质量=砝码质量 游码质量"得出:药品实际质量=砝码质量-游码质量=15g-3g=12g;(3)由图示中所示数据可得,每小格所表示的体积为1mL,水的体积为82mL,再由水的密度1g/mL,由公式m=ρV得出水的质量为:82mL×1g/mL=82g,由托盘天平中砝码与游码的质量可知,该实验欲称药品质量为:10g 5g 3g=18g,溶液质量为:82g 18g=100g,由溶质质量分数的计算公式得溶质质量分数为:×100%=18%;实际配制的溶液中溶质的质量为12g,取用的水的质量为82mL,计82g,所配制的溶液的溶质质量分数为×100%=12.8%;(4)溶液中溶质质量不变还是12g;溶液变为12g 82g 6g=100g,所得溶液溶质质量分数为×100%=12%;(5)溶液中溶解的氯化钠12g,加入23g,共35g,而溶剂水为88g,设能溶解溶质质量为x,则:=,x=31.68g,不能全溶,所得溶液是氯化钠的饱和溶液,所得溶液溶质质量分数=×100%=26.5%。
8. (1)c (2)a、b (3)c、d、g (4)玻璃棒
解析:(1)镁条燃烧放出大量的热量,因此夹持镁条用坩埚钳;(2)配制溶液的步骤是:计算、称量、溶解。用量筒量取水的体积,在烧杯中溶解固体,用玻璃棒搅拌加速溶解;(3)蒸发液体时,蒸发的容器是蒸发皿,酒精灯加热溶液,坩埚钳夹持蒸发皿,玻璃棒搅拌避免局部过热造成液体飞溅;(4)配制溶液需要用玻璃棒搅拌加速溶解;蒸发时,玻璃棒的作用是搅拌避免局部过热造成液体飞溅。
9. 【实验分析】(1)5.0g粗盐全部加入10mL水中
(2)当液体蒸干时才停止加热(没有在蒸发皿中出现较多固体时就停止加热) B
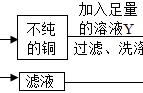
【实验设计】①出现白色沉淀 MgCl2 2NaOH

Mg(OH)2↓ 2NaCl
②碳酸钠(Na2CO3) CaCl2 Na2CO3

CaCO3↓ 2NaCl
解析:【实验分析】(1)将5.0g粗盐全部加入10mL水中,其中的氯化钠可能不能全部溶解,所以得出的产率偏低;(2)对液体进行蒸发时当蒸发皿中出现大量固体时就应该停止加热,用蒸发皿的余热来蒸干液体,否则会导致固体飞溅,在该操作中玻璃棒的作用是搅拌使液体受热均匀,防止因局部温度过高,造成液滴飞溅;【实验设计】①氯化镁可以和氢氧化钠反应生成白色沉淀,该反应的化学方程式为MgCl2 2NaOH

Mg(OH)2↓ 2NaCl;②氯化钙可以和碳酸钠反应生成白色的碳酸钙沉淀,该反应的化学方程式为CaCl2 Na2CO3