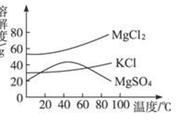
实验1 实验2 实验3

实验4
(1)实验1的现象白磷燃烧,产生白烟,气球先膨胀后收缩。气球的作用是缓冲作用,防止橡胶塞弹开。
为何要在锥形瓶底放一些沙子防止锥形瓶炸裂。反应后,天平是否平衡 平衡 。
(2)实验2的现象是铁钉表面出现红色固体,溶液由蓝色变浅绿色,
化学方程式 CuSO4 Fe=FeSO4 Fe 。
(3)实验3结束后,天平是否平衡?否 ,原因是反应生成的CO2逸出到空气中,未称量。
如何改进装置以验证质量守恒定律 放到密封装置中进行实验 ,
化学方程式 Na2CO3 2HCl=2NaCl H2O CO2↑。
(4)实验4:镁条燃烧,反应前称量石棉网和镁条质量,反应后称量石棉网和燃烧后得到的产物质量:
①如果测得反应后质量比反应前质量大,原因 增加了的氧元素的质量比损失的氧化镁质量大
②如果测得反应后质量比反应前质量小,原因 损失的氧化镁质量比增加的氧元素的质量大。
③如果测得反应后的质量与反应前总质量相等,原因是 参加反应且未称量的氧气的质量恰好等于损失的氧化镁的质量 。
11.C、CO和CO2的性质实验。

实验一 实验二

实验三 实验四
(1)实验一:试管内实验现象是固体由黑色变成红色 ,化学方程式是 C+2CuO 高温= 2Cu+CO2↑。澄清石灰水处的现象是出现白色浑浊,化学方程式是 CO2 Ca(OH)2=CaCO3↓ H2O。
在酒精灯上加网罩的作用是集中火焰,提高温度。
反应完毕后,要先撤出导管 ,然后熄灭酒精灯 ,目的是防止石灰水倒流使试管炸裂 。
为什么要待试管冷却后才将粉末倒在纸上观察?防止灼热的铜重新被空气中的氧气氧化。
(2)实验二:硬质玻璃管内的现象是 黑色的固体变红色 ,化学方程式 CO+CuO ∆ Cu+CO2 。
(3)实验三:倒了适量水后,旋紧盖子,观察到的现象是矿泉水瓶变扁了,得到此现象的原因分析二氧化碳能溶于水,瓶内气体减少,压强减小,大气压将瓶压扁了。
(4)实验四:倾倒二氧化碳:观察到的现象是下层蜡烛先熄灭,上层蜡烛后熄灭,该实验说明二氧化碳具有的物理性质:密度比空气大,化学性质:不能燃烧也不支持燃烧,所以CO2可用于 灭火。
12. 二氧化碳是否和水发生化学反应的探究。
实验 内容 |
栏目热文
文档排行本站推荐
Copyright © 2018 - 2021 www.yd166.com., All Rights Reserved. |