一、中考初中化学综合题
1.金属及其金属材料在人类生产、生活中的作用发生了巨大变化。
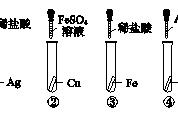
(1)我国第五套人民币硬币的成分如下:一角币用不锈钢,伍角币在钢芯表面镀铜,一元币在钢芯表面镀镍(Ni)。为探究镍在金属活动性表中的位置,课外小组的同学设计了如图所示实验。

①B中有气泡产生,反应的化学方程式为_____。
②C中观察到的现象是_____。
(2)首钢旧址中,一座座废弃的高炉已经锈迹斑斑,用硫酸可以除去铁锈,其化学方程式为_____。这些废弃的高炉曾经用于炼铁,用化学方程式表示一氧化碳和赤铁矿(主要成分为Fe2O3)炼铁的反应原理_____。
(3)钛白粉的化学名称是二氧化钛(TiO2),无毒,有极佳的白度和光亮度,是目前性能最好的白色颜料。以主要成分为TiO2的金红石作原料,通过氯化法可以制备钛白粉,主要流程如下:

①TiO2中钛元素的化合价是_____。
②补全TiCl4与氧气反应的化学方程式:TiCl4 O2
_____Cl2 _____。
③根据绿色化学理念,生产过程中应充分利用原料和减少有害物质排放。从绿色化学的角度看,该工艺流程的明显优点是_____。
【答案】Ni 2HCl=H2↑ NiCl2 无现象 Fe2O3 3H2SO4 == Fe2(SO4)3 3H2O Fe2O3 3CO
2Fe 3CO2 4 2 TiO2 氯气循环利用或减少有害气体排放
【解析】
【分析】
【详解】
(1)①B中有气泡产生,是镍与盐酸发生了反应生成了氢气,反应的化学方程式为:Ni 2HCl=H2↑ NiCl2。
②由于镍能与稀盐酸反应,说明了镍在金属活动性顺序表中位于氢的前边,活动性大于铜,所以C中观察到的现象是无现象。
(2)铁锈的成分是氧化铁,用硫酸可以除去铁锈,其化学方程式为Fe2O3 3H2SO4 == Fe2(SO4)3 3H2O;用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的反应物是一氧化碳和氧化铁,写在等号的左边,生成物铁和二氧化碳写在等号的右边,根据得失氧进行配平,反应条件是高温写在等号的上边,所以化学方程式为:Fe2O3 3CO
2Fe 3CO2
(3)①氧的化合价为-2价,设钛的化合价为x,x (-2)×2=0,x= 4;
②补全TiCl4与氧气反应的化学方程式:TiCl4 O2
2Cl2 TiO2。故填:2;TiO2;
③根据绿色化学理念,生产过程中应充分利用原料和减少有害物质排放,氯气有毒,可以循环使用,氯气循环利用或减少有害气体排放。
故答案为
(1) 4;
(2)2,TiO2;
(3)氯气循环利用或减少有害气体排放。
2.央视《是真的吗?》栏目中有一段视频:将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧。据此,某实验小组同学取某种“锡纸”进行了以下探究。
(1)“锡纸”燃烧的原因:“锡纸”两端接入电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件分析:开始“锡纸”不燃烧,但短路后却能燃烧的原因是 。
(2)探究“锡纸”中金属的成分:“锡纸”中的金属是锡吗?
(查阅资料)①“锡纸”是锡箔或铝箔和纸粘合而成;②锌粉是一种深灰色固体;
③ 锡(Sn)与酸或盐溶液反应生成 2价的锡盐。
(提出猜想)猜想Ⅰ:“锡纸”中的金属是锡;猜想Ⅱ:“锡纸”中的金属是铝。
(进行实验)设计方案并进行实验。
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序可知猜想 (填“Ⅰ”或“Ⅱ”)成立;反应的化学方程式为: 。 |
(交流讨论)①实验中打磨“锡纸”的目的是 ;
②下列物质的溶液不可以替代氯化锌溶液完成上述实验的是 (填序号)。
A.氯化铜 B.硝酸银 C.硫酸钠 D.硫酸亚铁
(反思应用)
电器短路会引起火灾,我们要严加防范。如果电器着火应该采取的灭火方法是: 。
(探究拓展)该小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分为6等份依次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
稀硫酸用量 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 | 第6份 |
剩余固体质量 | m | 2.0g | 1.5g | 1.0g | 0.6g | 0.6g |
(3)表格中,m= 。
(4)合金样品中镁的质量= 。
(5)计算所用稀硫酸中H2SO4的质量分数。(要求写出计算过程,下同)
(6)计算当加入第4份硫酸溶液且充分反应后所得溶液中溶质的质量分数。
【答案】(1)温度达到了着火点;(2)Ⅱ;2Al 3ZnCl2=3Zn 2AlCl3;除去表面的氧化物;ABC;先切断电源,然后用干粉灭火器扑灭或者用沙土盖灭;(3)2.5g;(4)2.4g;(5)20.4% ;(6)23.9%
【解析】
探究一:“锡纸”与氧气接触,但是开始“锡纸”不燃烧而短路后却能燃烧的原因是短路时,温度升高,温度达到了“锡纸”的着火点;
探究二:【进行实验】铝比锌活泼,而锡不如锌活泼,所以打磨后的“锡纸”片放入试管中,滴加氯化锌溶液.若有深灰色固体析出则为铝,若没有深灰色固体析出则为锡;铝与氯化锌反应生成锌和氯化铝;故答案为Ⅱ成立;反应的化学方程式为 2Al 3ZnCl2=3Zn 2AlCl3;
【交流讨论】(1)实验中打磨“锡纸”的目的是除去表面的氧化物;
(2)选择的盐溶液中的金属元素应介于铝和锡之间,铜和银均排在锡的后面,钠排在铝的前面,而铁介于二者之间,硫酸亚铁满足条件,故答案为ABC;
【反思应用】
因水能导电,则如果电器着火应采取的灭火方法是先切断电源,然后用干粉灭火器扑灭或者用沙土盖灭;
【探究拓展】
(3)第2和3实验对比中可知,每10g稀硫酸能与0.5g镁反应,可知第一次剩余固体为3g-0.5g=2.5g;
(4)由最后剩余0.6g固体可知,镁的质量为3g-0.6g=2.4g;
(5)根据每10g稀硫酸能与0.5g镁反应,设10g硫酸中溶质的质量为x,
Mg H2SO4=MgSO4 H2↑
24 98
0.5g x

,解得:x=2.04g
则稀硫酸中溶质的质量分数为