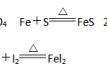一,金属铁及其化合物的转化关系

二,重要物质的性质和化学方程式
1,铁单质——只具有还原性
①3Fe+2O2===Fe3O4(反应条件点燃)
②Fe+S===FeS(反应条件加热)
③2Fe+3Cl2===2FeCl3(反应条件加热)
④3Fe+4H2O(g)===Fe3O4+4H2(反应条件高温)
⑤Fe+2H+===Fe2++H2↑(酸为非氧化性酸)
⑥Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O(铁适量)
⑦3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O(铁过量)
⑧Fe+CuSO4===Cu+FeSO4
⑨2FeCl3+Fe===3FeCl2
注意:
(1)Fe与O2、H2O(g)反应的产物都是Fe3O4而不是Fe2O3
(2)Fe与Cl2反应时生成FeCl3,与S反应时生成FeS,与I2反应生成FeI2,与反应物的用量无关。说明Cl2的氧化能力大于S和I2的。(3)常温下,Fe、Al在冷的浓硫酸和浓硝酸中发生钝化,但加热后继续反应。
(3)过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,均生成Fe2 。要注意产生的Fe3 还可以氧化单质Fe这一隐含反应:Fe 2Fe3 ===3Fe2 。
2,铁的氧化物和氢氧化物——通常与酸反应, 2价具有还原性, 3价具有氧化性
FeO+2HCl===FeCl2+H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe3O4+8HCl===2FeCl3+FeCl2+4H2O
3FeO+10HNO3(稀)===3Fe(NO3)3+NO↑+5H2O
3Fe3O4+28HNO3(稀)===9Fe(NO3)3+NO↑+14H2O
Fe(OH)2+2HCl===FeCl2+2H2O
Fe(OH)3+3HCl===FeCl3+3H2O
3Fe(OH)2+10HNO3(稀)===3Fe(NO3)3+NO↑+8H2O
2Fe(OH)3+6HI===2FeI2+I2+6H2O
4Fe(OH)2+O2+2H2O===4Fe(OH)3
注意:
(1)Fe2O3、Fe(OH)3与氢碘酸反应时,涉及Fe3 与I-的氧化还原反应,产物为Fe2 、I2和H2O。
(2)亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3 ,也可能含有Fe2 。
(3)制备Fe(OH)2的方法很多,原则有两点,一是溶液中的溶解氧必须提前除去,二是反应过程中必须与O2隔绝。
3,铁盐——与碱反应,可以发生络合反应, 2价具有还原性, 3价具有氧化性
FeCl2+2NaOH===Fe(OH)2↓+2NaCl
2FeCl2+Cl2===2FeCl3
Fe3++3SCN-===Fe(SCN)3
FeCl3+3H2O(沸水)===Fe(OH)3(胶体)+3HCl(氢氧化铁胶体的制备需要小火慢炖的加热)
Fe2O3·nH2O+3H2O(=====)铁发生吸氧腐
注意:
(1)FeCl2溶液与NaOH溶液在空气中反应的现象变化,常用于物质推断。向Fe2+溶液中加入硝酸、KMnO4溶液、氯水等具有氧化性的物质时,溶液会出现浅绿色→棕色的颜色变化,该现象可用于Fe2+的初步检验。
(2)Fe3+的检验方法较多,比如观察溶液颜色法(棕黄色)、加入NaOH溶液法(生成红褐色沉淀或红棕色沉淀)、加入KSCN溶液法(生成血红色溶液),前面两种方法需溶液中Fe3+浓度较大时才适用,最好也最灵敏的方法是KSCN溶液法;Fe2+的检验可采用先加入KSCN溶液后再加入氧化剂的方法,也可以加入铁氰化钾溶液(出现蓝色沉淀),也可以加入氢氧化钠溶液(白色沉淀——灰绿色——红褐色)。
(3)FeCl3溶液加热浓缩时,因Fe3 水解和HCl的挥发,越热越水解,得到的固体为Fe(OH)3,灼烧后得到红棕色Fe2O3固体;而Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性的酸,将得不到Fe(OH)3固体,最后得到的固体仍为Fe2(SO4)3。
三,实际应用要点
1,Fe在Cl2中燃烧,无论Cl2过量还是不足均生成FeCl3。
2,生成FeCl2除了用Fe和HCl的置换反应外,还可用化合反应:2FeCl3+Fe===3FeCl2;生成Fe(OH)3除了用Fe3+与碱的复分解反应外,还可用化合反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3。
3,配制FeCl2溶液既要防氧化(加入Fe粉),又要防水解(加入盐酸);配制FeCl3溶液要加入浓盐酸防止水解。
4,Fe3+必须在酸性条件下才能大量存在,当pH=7时,Fe3+几乎完全水解生成Fe(OH)3沉淀。
5,除去酸性溶液ZnCl2中的FeCl2,应先通入Cl2或加入H2O2,再加入ZnO,使Fe3+水解生成沉淀过滤除去。