DNA转录调控功能障碍通常与人类疾病有关。为了解转录调控,科学家已经开发了全基因组测序方法来分析RNA聚合酶(Pol II ChIP-seq)或检测新生RNA水平。其中,新生RNA检测方法通常包括连续检测、Pol II相关或染色质相关的RNA富集。但以上这些方法仍存在一定的局限性。例如ChIP-seq方法无法区分RNA聚合酶是简单结合还是积极参与转录。Pol-II相关RNA富集方法通常需要数百万个细胞作为起始材料。其他方法可能无法准确地测量瞬时和低丰度RNA。
此外,大多数RNA会经过转录后处理,以上方法检测的是RNA的间接水平,可能无法准确反映原位转录动态。科学家认为,由于参与转录的RNA聚合酶可分解DNA的双螺旋并产生“单链DNA气泡”,如果在整个基因组中定位单链DNA(ssDNA)可提供参与转录的RNA聚合酶活性和动力学信息。

来源:Nature Methods
近日,芝加哥大学何川研究团队开发了一种新的单链DNA测序(KAS-seq)方法。KAS-seq可在全基因组范围内快速、敏感地检测和定位由转录或其他过程产生的ssDNA,且只需使用1000个细胞即可实现。4月6日,该研究成果在Nature Methods上发表,文章题为“Kethoxal-assisted single-stranded DNA sequencing captures global transcription dynamics and enhancer activities in situ”。
该方法基于N3-kethoxal和鸟嘌呤在ssDNA中快速而特异性的反应开发。N3-kethoxal分子能够在5分钟内特异性的和活细胞中单链状态的鸟嘌呤反应,被修饰的RNA片段可通过相互作用富集。值得关注的是,N3-kethoxal修饰是可逆的,加热后即可被去除。


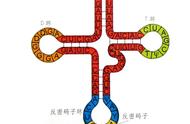
KAS-seq验证和KAS-seq概述,来源:Nature Methods
研究人员将N3-kethoxal加入细胞培养液,5分钟后提取富集标记后的DNA片段并建库测序。结果显示,KAS-seq信号在基因编码区显著富集,且具有较高的灵敏度。当Pol II延伸被抑制时,KAS-seq信号仅出现在启动子;当Pol II结合被抑制时,该信号在基因编码区完全消失。此外,KAS-seq能同时检测Pol I和Pol lIII介导的转录活性,表明该方法可准确检测全基因组DNA转录活性。
研究发现,KAS-seq可以定义一组具有独特序列基序的单链增强子。这些增强子与特定的转录因子结合有关,并且比典型的增强子表现出更多的增强子-启动子相互作用。在抑制蛋白质凝结的条件下,该方法可发现从一组启动子中快速释放的Pol II。KAS-seq有助于以高通量方式同时快速、准确地分析转录动力学和增强子活性,未来或可广泛运用在转录变化的动态检测中。

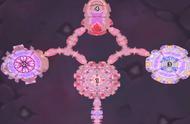
低输入量细胞和小鼠肝脏的KAS-seq检测结果。来源:Nature Methods
此外,KAS-seq利用1000个细胞产生的数据与使用大量细胞产生的数据相似,可用于低起始量细胞或冷冻动物组织中的ssDNA检测,甚至有可能用于活体动物上。
总而言之,何川团队最新开发的KAS-seq方法,是一种简单、低起始量、高灵敏度的ssDNA测序方法,可同时检测转录活性、增强子活性以及DNA结构变化,适用于稀有样本的转录动态变化检测。研究团队表示,随着技术的优化,KAS-seq有望实现单细胞、甚至单分子层面的ssDNA检测,成为转录以及其他生物过程研究中不可或缺的工具。
参考资料:
Kethoxal-assisted single-stranded DNA sequencing captures global transcription dynamics and enhancer activity in situ. Nature Methods (2020)
https://www.nature.com/articles/s41592-020-0797-9
,