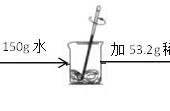
==

(1分)
X=0.033g (1分)
(2)消耗盐酸的体积为

=0.5mL(2分)
(3)它是微型实验用药量的

=10(倍)(1分)
答:(1)生成二氧化碳的质量为0. 033 g
(2)消耗盐酸的体积为0. 5 mL
(3)是微型实验用药量的10倍。
【解析】根据碳酸钙与盐酸反应的化学方程式和元素的质量,列出比例式,就可计算出生成二氧化碳的质量;根据“体积=质量÷密度”计算即可;通常完成这个实验所用盐酸的体积÷微型实验用药的体积,就是倍数.
(1)设生成二氧化碳的质量为x,
CaCO3 2HCl=CaCl2 H2O CO2↑
73 44
0.55g×10% x
∴73:44=(0.55g×10%):x,
解之得:x=0.033g;
(2)消耗盐酸的体积是:0.55g÷1.1g/cm3=0.5mL;
(3)5mL÷0.5mL=10.
答:(1)产生CO2的质量是0.033g;
(2)消耗盐酸的体积是0.5mL;
(3)这是微型实验用药量的10倍.
本题主要考查学生运用化学方程式和质量、密度与体积的关系综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力