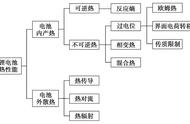
(2012年广州)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:

(1)写出下列反应的化学方程式:
反应①:_____________________________________________________;
反应②:___________________________________________________。
(2)反应①所用的硫酸的质量分数为24.5%。现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水。实际操作时,用lOml量筒取98%的硫酸(密度为1.84g/cm3),请在答题卡图中画出所取硫酸的液面。
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行。
(4)试剂A可选用___________溶液(填一种物质的化学式)。
(5)为了从混合粉末中回收更多的铜,可对实验方案进行修改和完善,你的建议是(提出一条即可)____________________________________。

【解析】:(1)氧化铜能与硫酸反应生成硫酸铜。铜和木炭不反应也不溶于水。滤液Ⅰ是硫酸铜和剩余硫酸的混合物。滤渣Ⅰ是铜和炭粉。滤渣Ⅱ是铜和铁的混合物;滤液Ⅱ是硫酸亚铁溶液。除去铜中的铁可以用硫酸或硫酸铜溶液,使铁反应生成溶于水的物质,再过滤将不反应的铜分离。(2)配置稀硫酸时,根据稀释前后溶质的质量不变进行计算。配制40g 24.5%的硫酸需要98%浓硫酸的质量为:40g×24.5%/98%=10g,浓硫酸的体积等于质量除密度。水的质量=40g—10g=30g。量筒量取液体时,视线与凹液面的最低处保持水平。过滤分离混合物时,通常先将混合物溶解,再用玻璃棒搅拌加速溶解。(5)滤渣Ⅰ是铜和炭粉的混合物,可以回收到更多的铜。
答案:(1)反应①:H2SO4 CuO === CuSO4 H2O
反应②:Fe CuSO4 === FeSO4 Cu
(2) 10g;30g。 所取硫酸的体积为5.4mL(如图所示)
(3)烧杯;用玻璃棒不断搅拌。
(4)H2SO4 (CuSO4 等合理即给分)
(5)回收滤渣I中的Cu