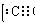反应原理
得到平稳的乙炔气流:
CaC2 2H2O→C2H2↑ Ca(OH)2(注意不需要加热)

固液不加热(不能用启普发生器)

实验室制备乙炔装置图
请观看视频实验—乙炔的实验室制法
实验 | 现象 |
点燃验纯后的乙炔 | 火焰明亮并伴有浓烟(含碳量较高) |
将纯净的乙炔通入盛有高锰酸钾酸性溶液的试管中 | 溶液紫色褪去(发生氧化反应,乙炔被氧化为二氧化碳和水) |
将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中 | 溶液褪色(发生加成反应) |
①常用饱和氯化钠溶液代替水(减小浓度,降低反应速率)
②分液漏斗控制水的流速 ③并在导气管口加棉花,防止泡沫喷出。
生成的乙炔有臭味的原因:夹杂着H2S、PH3、AsH3等特殊臭味的气体,可用CuSO4溶液或NaOH溶液除去杂质气体。
①反应放出的大量热,易损坏启普发生器(受热不均而炸裂)。
②反应后生成的石灰乳是糊状,可夹带少量CaC2进入启普发生器底部,堵住球形漏斗和底部容器之间的空隙,使启普发生器失去作用。

启普发生器不可以用来制备乙炔