内能
internal energy
定义:系统内部所有分子间势能和各种动能的能量总和,但不包括系统作为整体运动的动能。
学科:化工名词_化工热力学
相关名词:动能 势能 热力学能
来源:全国科学技术名词审定委员会
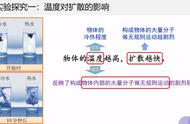
内能是物质中分子的动能和势能的总和。很显然,我们不可能测定物体内每一个分子的动能和势能,因此内能实质上是统计性质的,是分子动能和势能的统计平均值。分子动能和温度有关,温度越高,分子运动速率越大,动能越大;势能则和密度(或者说体积)有关,单位体积内的分子质量(或者说数目)越多,分子势能越大。因此内能可通过温度和密度确定,它也是一个状态函数。
内能和总能量是不同的。普遍来说,一个体系的总能量E由三部分组成,包括内能U、体系整体运动的动能K和体系在外场(如重力场)中的势能V,后两项的和又被称为外能。
一般而言,我们不关心内能的绝对值,而关注内能的变化量。热力学第一定律指出:物体内能的增加等于物体吸收的热量和对物体所做的功的总和,这是能量转化与守恒定律在热学中的具体表现。换言之,我们可以通过做功和热传递两种方式来改变系统的内能,而将这两种方式统一起来的,正是著名的焦耳热功当量实验。焦耳通过搅拌和通电等方式对绝热容器中的水做功,并测量其温度的升高量,得到了1cal=4.157Nm的结果,与现在的公认值1cal=4.184Nm非常接近(1cal是指在标准大气压下使1g纯水温度升高1℃所需的热量,目前在营养学等领域中仍作为热量的单位使用)。这一实验证明了热和功的相当性,肯定了热是能量的一种形式,打破了当时物理学界“热质说”的统治,为能量转化与守恒定律的建立奠定了可靠的实验基础。
,