本展项让观众了解同位素的概念,了解质子数决定元素种类,中子数决定同位素,并了解碳的同位素14C在检测年份方面的重要应用。
①什么是同位素?
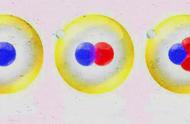
质子和中子被发现后,人们认识到,元素的差别在于质子的差别,只要原子核内质子数相同,就可以归为同一种元素。而所谓“同位素”,是同一元素的不同原子,具有相同的质子数,但中子数却不同。

例如:氢的三种原子氕、氘和氚,它们原子核中都有1个质子,却分别有0个中子、1个中子及2个中子,所以它们互为同位素。
②同位素性质有何异同?
同位素具有相同原子序数,在元素周期表上占有同一位置,化学性质几乎相同(氕、氘和氚的性质有些微差异),但原子质量或质量数(质子数 中子数)不同,从而其质谱性质、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
③同位素的表示方法
同位素的表示方法是在元素符号的左上角注明质量数,左下角注明质子数。例如由6个质子和8个中子组成的碳原子,表示为
④同位素有什么用途?
许多同位素有重要的用途,例如碳12是作为确定原子量标准的原子;氘和氚是制造氢弹的材料;铀235是制造核反应堆的原料和原子弹的材料;根据碳14衰变的程度来计算样品的大概年代。同位素示踪法广泛应用于科学研究、工农业生产和医疗技术方面,例如用氧18标记化合物确证酯化反应的历程,碘131用于甲状腺吸碘机能的实验等。
,