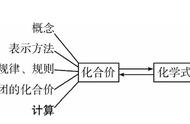
9.共价键的分类:共价键根据成键的性质分为非极性共价键和极性共价键。
(1)极性键:由不同种元素的原子形成的共价键(共用电子对偏向吸引电子能力强的一方)。存在范围:气态氢化物、非金属氧化物、酸根、氢氧根、有机化合物。
(2)非极性键:由同种元素的原子间形成的共价键(共用电子对不偏移)。存在范围:非金属单质(稀有气体除外)及某些化合物中,如H2、N2、O2、H2O2中的O-O键、Na2O2中的O-O键。
要点诠释:
①共价键和离子键的实质相同,都属于电性作用。成键原因都是原子,都有使自身的最外层达到稳定结构状态的趋势。
②稀有气体原子的最外层都已达到稳定结构,因此稀有气体分子都是单原子分子,分子内不形成化学键。
要点三、离子化合物和共价化合物

要点四、化学键
1.概念:使离子或原子相结合的作用力通称为化学键。
(1)化学键是“相邻”离子或原子间的相互作用;物质内不相邻的离子或原子间也有相互作用,它们之间的相互作用不是化学键;
(2)化学键是强烈的相互作用,所谓“强烈”是指原子间存在电子的转移,即共用电子对的偏移或电子的得失。
2.种类:

2.化学反应的实质
化学反应是反应物中的原子重新组合为产物分子的过程,在这个过程中,包含着反应物分子内化学键的断裂和产物分子中化学键的形成,即化学反应的实质是旧化学键的断裂和新化学键的形成。
要点五、电子式的书写
要点诠释:
化学反应中,一般是原子的最外层电子发生变化,为了表示这些化学反应的实质,引入了电子式,即由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
1.各种粒子的电子式的书写:
(1)原子的电子式:常把其最外层电子数用小黑点“·”或小叉“×”来表示。例如: