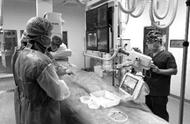
FDA于2017年3月24日发布一则最新召回通告,由飞利浦生产的一款监控和除颤设备(以下统称为除颤仪)因电路问题可能导致设备无法正常运行而被召回。FDA已将其列为I级召回,也是最严重的召回类型,使用了这种设备可能引发严重医疗事故甚至死亡。
该除颤仪连接两片贴附电极,将此电极贴附于患者胸前,并进行心律的监控,当检测到心律不正常,如心跳缓慢、心律不齐或心搏骤停时,则释放电流,通过两片电极间的电流传导使患者恢复正常心律。
此次召回的具体原因是因为电路故障以及电池连接故障可能会阻止能量的提升,影响充电和电流释放,同时起搏功能还可能发生非预期的停止输出。
2017年2月飞利浦就此事件制定了紧急纠正方案并通告其用户。还给出了一系列措施帮助用户去检查设备是否存在问题。由此可见召回意义非常重大,当产品存在安全缺陷时,我们通过召回可以及时的保护使用者/患者,将危害/风险所带来损失后果降到最低,美国企业对待召回的态度和做法也值得我们中国企业学习。

HeartStart MRx Monitor/Defibrillator
召回产品信息:
• 产品名称:HeartStart MRx Monitor/Defibrillator
• 型号: M3535A (M3535ATZ) M3536A (M3536ATZ), M3536M, M3536MC, M3536M2, M3536M4, M3536M5, M3536M6, M3536M7, M3536M8, M3536M9
• 生产日期: 2004.2.11- 2016.11.4
• 分销日期: 2004.2.12- 2016.11.4
• 美国境内召回数量: 47,362台
本文系奥咨达法规团队整理,版权归奥咨达所有,欢迎转载!转载请注明出处。
,