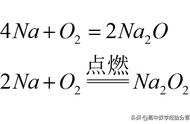1.水在氧化还原反应中的作用
(1)、水作氧化剂
水与钠、其它碱金属、镁等金属反应生成氢气和相应碱:
水与铁在高温下反应生成氢气和铁的氧化物(四氧化三铁):
水与碳在高温下反应生成“水煤气”:
铝与强碱溶液反应:
(2)、水做还原剂
水与F2的反应:
(3)、水既做氧化剂又做还原剂
水电解:
(4)、水既不作氧化剂也不作还原剂
水与氯气反应生成次氯酸和盐酸
水与过氧化钠反应生成氢氧化钠和氧气
水与二氧化氮反应生成硝酸和一氧化氮
2.水参与的非氧化还原反应:
(1)、水合、水化:
水与二氧化硫、三氧化硫、二氧化碳、五氧化二磷等酸性氧化物化合成酸。(能与二氧化硅化合吗?)
水与氧化钠、氧化钙等碱性氧化物化合成碱。(氧化铝、氧化铁等与水化合吗?)
氨的水合、无水硫酸铜水合(变色,可检验液态有机物中是否含水)、浓硫酸吸水、工业酒精用生石灰吸水然后蒸馏以制无水酒精、乙烯水化成乙醇
(2)、水解:
卤代烃水解、乙酸乙酯水解、油脂水解(酸性水解或皂化反应)、水与碳化物——电石反应制乙炔、盐类的水解、氮化物水解、糖类的水解、氢化物——氢化钠水解
3.名称中带“水”的物质
(一)、与氢的同位素或氧的价态有关的“水”。
蒸馏水—H2O重水—D2O超重水—T2O双氧水—H2O2
(二)、水溶液
氨水—(含分子:NH3,H2O,NH3·H2O,含离子:NH4 ,OH-,H )
氯水—(含分子:Cl2,H2O,HClO,含离子:H ,Cl-,ClO-,OH-)
卤水—常指海水晒盐后的母液或粗盐潮解所得溶液,含NaCl、MgCl2、NaBr等
王水—浓硝酸和浓盐酸的混合物(1∶3)
生理盐水—0.9%的NaCl溶液
(三)、其它水银—Hg水晶--SiO2水煤气—CO、H2的混合气、水玻璃—Na2SiO3溶液
与水有关的化学方程式
2H2O=(通电)2H2↑ O2↑(电解水,反映极慢)
H20 Ca0=Ca(OH)2(生石灰与水反应,放出大量热)
2Na 2H2O=2NaOH H2↑(金属钠与水反应,剧烈放热,钠块在水上游动)
2K 2H20=2KOH H2↑(金属钾与水反应,剧烈放热,K块快速游动,有时带紫色火焰)
Ca 2H2O=Ca(OH)2 H2↑(金属钙和水反应,开始反应快,之后反应减弱)
Na2O H2O=2NaOH(氧化钠和水反应,放热)
CuSO4 5H2O=CuSO4·5H2O(无水硫酸铜溶于水,显蓝色,用于检验水的存在)
CO2 H2O=H2CO3(二氧化碳溶于水,可逆反应)
SO2 H2O=H2SO3(二氧化硫溶于水,可逆反应)
SO3 H20=H2SO4(三氧化硫溶于水,放出大量热,用于工业制硫酸)
4Fe 3O2 2xH2O=2Fe2O3·xH2O(铁生锈反应)[初中可以这么写]
2Cu O2 H2O CO2=CU2(OH)2CO3(铜生锈反应,生成物为碱式碳酸铜,又称孔雀石,绿色)
C H2O=CO H2(高温下反应,用于工业生产水煤气,把水泼到滚烫的碳炉上也会发生此反应)
基本上就这些了,以下是材料题中有时会出现的:
CaC2 2H2O=Ca(OH)2 C2H2(又写作CH≡CH,乙炔)↑(电石,又称碳化钙与水反应,放出大量热)
P2O5 3H2O=2H3PO4(五氧化二磷与热水反应)
Na2O2 2H2O=4NaOH O2↑(过氧化钠与水反应,放热,使脱脂棉燃烧)
4K02 2H20=4KOH 3O2↑(超氧化钾和水反应,同上)
3NO2 H2O=2HNO3 NO(二氧化氮溶于水,用于工业制硝酸)
2NaCl 2H2O=2NaOH H2↑ Cl2↑(电解饱和氯化钠溶液)
来源:高考网
,