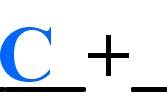离子反应
学习目标
1.了解离子反应的概念,利用实验探究离子反应发生的条件。
2.能够书写常见的离子方程式,并能进行正误判断。
3.结合电解质知识,掌握常见离子能否大量共存的判断方法。
重难点
1.物质的拆与不拆
2.离子方程式的书写
知识导学
一.离子反应
1.向盛有2mL Na2SO4溶液的试管里加入2mLBaCl2溶液,出现白色沉淀。
原因:Ba2+和SO42-生成BaSO4沉淀
发生化学反应:BaCl2+Na2SO4===BaSO4↓ 2NaCl

从微观角度看,其实质是: Ba2++SO4(2-)===BaSO4↓ , Na 离子和 Cl- 离子没有参与反应。
2.电解质溶于水后,电离成为自由移动的离子。因此,电解质在溶液中的反应一定与 离子 有关。
(1)离子反应概念: 有离子参加或有离子生成的反应 称为离子反应。
电解质溶液的反应实质上就是电离出的某些离子之间的反应。
二.离子方程式
1.离子方程式概念: 用实际参加反应的离子符号来表示反应的式子叫离子方程式 。
2.书写步骤(以氯化钡与硫酸钠溶液反应为例):
写—正确书写反应的化学方程式:__BaCl2+Na2SO4===BaSO4↓+2NaCl__
拆—把__易溶于水且易电离__的物质拆成离子的形式:__Ba2++2Cl-+2Na++SO4(2-)===BaSO4↓+2Na++2Cl-__。
删—删去方程式两边__不参加反应__的离子__SO4(2-)+Ba2+===BaSO4↓__
查—检查方程式两边元素的原子个数和电荷总数是否相等。
【点拨】不参加反应的离子指方程式两边完全相同的离子。
3.意义:

【结论】强酸与强碱发生中和反应的实质是,强酸电离出的__H+__与强碱电离出的__OH-__结合生成__H2O__。
离子方程式不仅可以表示__某个具体的化学反应__,还可以表示__同一类型的离子反应__。
三.离子反应的类型及发生反应的条件
1.类型:复分解反应和置换反应等。
2.离子反应条件的探究实验:

三个实验中发生反应的离子方程式分别是
①__Cu2++2OH-===Cu(OH)2↓__
②__H++OH-===H2O__
③__CO3(2-)+2H+===CO2↑+H2O__
3.复分解反应类离子反应的发生条件:

【知识进阶】
一.离子方程式的书写及正误判断
【问题探究】
1.H++OH-===H2O能表示所有的强酸和强碱发生的反应吗?
不能。如H2SO4与Ba(OH)2反应除H+和OH-生成H2O外,Ba2+与SO4(2-)反应还生成BaSO4沉淀,故其离子方程式为Ba2++2OH-+2H++SO4(2-)===BaSO4↓+2H2O。
2.根据复分解反应发生的条件分析离子反应发生后的结果是什么?
复分解反应发生的条件是生成沉淀、放出气体或生成水(具备上述条件之一即可);因此离子反应发生后导致溶液中某些离子浓度明显减小。
【知识归纳总结】
1.书写离子方程式的拆分原则:
(1)常见物质的拆分原则

(2)微溶物的书写原则
微溶物的澄清溶液要写成离子形式;呈浑浊状态或沉淀时要写成化学式,如澄清石灰水表示为“Ca2++2OH-”,而石灰乳表示为“Ca(OH)2”。
未完,有需要的朋友,私信,免费送哦
,