课题2 溶解度
一、饱和溶液与不饱和溶液
1、定义:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液;还能继续溶解的溶液,叫做不饱和溶液。
2、判断溶液是否饱和的方法:继续加入该种溶质,如果该物质的质量减少,那么溶液是不饱和溶液;如果该物质的质量不变,那么溶液是饱和溶液。
3、由于水可以和酒精以任意比例互溶,所以水和酒精不可以形成饱和溶液。
4、不饱和溶液与饱和溶液的转化

① 氢氧化钙和气体的溶解度随着温度升高而降低。所以若把氢氧化钙和气体的不饱和溶液变成饱和溶液,在改变温度时要升高温度。
② 最可靠的方法是蒸发溶剂、加溶质、加溶剂。
③ 若想把氢氧化钙的饱和溶液变成不饱和溶液,可以通入适量的二氧化碳并过滤。
④ 若想把氢氧化钙的不饱和溶液变成饱和溶液,也可以加入CaO并冷却。
⑤ 氢氧化钙不是晶体,从氢氧化钙溶液也不会析出晶体,所以只能称作“澄清的石灰水变浑浊”。
浓、稀溶液与饱和、不饱和溶液之间的关系:
① 饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
② 在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓。
【习题一】
(2018•郴州)下列关于溶液的说法正确的是( )
A.水是最常用的溶剂
B.饱和溶液一定比不饱和溶液浓度大
C.澄清、透明的液体一定是溶液
D.饱和溶液一定不能再继续溶解溶质
【考点】常见的溶剂;溶液的概念、组成及其特点;饱和溶液和不饱和溶液.
【分析】A、根据最常用的溶剂,进行分析判断。
B、根据选项没有指明温度,进行分析判断。
C、溶液是均一、稳定的混合物。
D、根据一定温度下,一种物质的饱和溶液还能溶解其它的溶质,进行分析判断。
【解答】解:A、最常用的溶剂是水,故选项说法正确。
B、选项没有指明温度,无法比较饱和溶液、不饱和溶液的浓度大小,故选项说法错误。
C、澄清、透明的液体一定是溶液,如水是澄清、透明的液体,但不是混合物,不是溶液,故选项说法错误。
D、一定温度下,一种物质的饱和溶液还能溶解其它的溶质,故选项说法错误。
故选:A。
5、分离可溶物和不溶物:过滤法(溶解、过滤、蒸发或溶解、过滤、洗涤、干燥)
1铁屑和其他固体:用磁铁反复吸引
2除去氯化钠中少量的硝酸钾:蒸发溶剂结晶法(蒸发溶剂)
3除去硝酸钾中少量的氯化钠:冷却热饱和溶液结晶法(高温溶解、降温、过滤)
(结晶:热的溶液冷却后,已溶解在溶液中的溶质从溶液中以晶体的形式析出,这一过程叫结晶)
(1)后两者往往应用在分离两种可溶于水的物质,并且其中一种的溶解度受温度影响大,另一种受温度影响小。我们希望析出的晶体是量多的一种,所以选用的方法要适合量多的那种。
(2)蒸发溶剂时溶液浓度不变,冷却热饱和溶液时溶液浓度变小。
(3)在一定温度和溶质相同的条件下,100g的饱和溶液和200g的饱和溶液,二者都蒸发10g水,析出晶体的质量相等。
(4)在60℃和溶质相同的条件下,把100g的饱和溶液和200g的饱和溶液降低到20℃,若前者析出晶体的质量为M,后者析出晶体的质量为N,那么N=2M。
【习题二】
(2018•莒县校级模拟)下列各组混合物,可用结晶法分离的是( )
A.石灰石粉末与水的混合物
B.木炭粉与水的混合物
C.汽油和植物油的混合液
D.食盐和硝酸钾的混合液
【考点】结晶的原理、方法及其应用.
【分析】利用两种或多种可溶性固体在同一种溶剂里溶解度的不同,而采用结晶方法加以分离的操作方法.如使硝酸钾与其中所含的氯化钠杂质分离,可以采用结晶的方法.
【解答】解:A、石灰石粉末难溶于水,分离石灰石粉末与水的混合物,采用过滤的方法即可,故选项错误。
B、木炭难溶于水,分离木炭粉与水的混合物,采用过滤的方法即可,故选项错误。
C、汽油和植物油均为难溶于水的液体,不能采用结晶法分离,故选项错误。
D、食盐和硝酸钾均溶于水,硝酸钾溶解度受温度变化影响较大,而氯化钠受温度变化影响较小,可以用结晶的方法将它们分离,故选项正确。
故选:D。
二、固体的溶解度
1、定义:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。

2四要素:
1温度——必须指明具体的温度,溶解性才有意义。
2溶剂的质量是100g。
3固体在溶解在溶液中,必须达到饱和状态。
4溶解度的单位通常是g。
3、影响固体溶解度的因素:
1(内因)溶质性质、溶剂性质;
2(外因)温度。
(1)一般来说,温度越高,固体的溶解度越大。
(2)溶解度的相对大小:温度是20℃,并且溶剂的质量是100g。
1在20℃下,溶解度小于0.01g,被称为难溶(或不溶);
2溶解度介于0.01~1g之间,被称为微溶;
3溶解度介于1~10g之间,被称为可溶;溶解度大于10g,被称为 易溶。
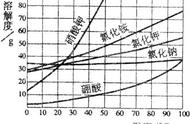
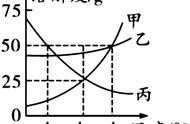
4、有关溶解度曲线的常见试题(见右上图)
(1)t3℃时A的溶解度为 80g 。
(2)P点的的含义是: 在该温度时,A和C的溶解度相同 。
(3)N点为 t3℃时A的不饱和溶液 ,可通过 加入A物质,降温,蒸发溶剂的方法使它变为饱和。
(4)曲线上的点代表对应温度的饱和溶液,曲线以下的点代表对应温度的不饱和溶液。
(5)加溶质相当于把点向正上方移动(但是点不能被移动到图象上方),加溶质相当于向下竖直移动,降温相当于向左水平移动,升温相当于向右水平移动。
(6)t1℃时A、B、C、溶解度由大到小的顺序 C>B>A 。
(7)从A溶液中获取A晶体可用 降温结晶 的方法获取晶体。
(8)从B的溶液中获取晶体,适宜采用 蒸发结晶 的方法获取晶体。
(9)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃会析出晶体的有 A和B ,无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A<C<B 。
(10)除去A中的泥沙用 过滤 法;分离A与少量B的混合物,用 结晶 法。
5、氯化钠等物质的溶解度受温度变化的影响较小;硝酸钾等物质的溶解度受温度变化的影响较大。
它们的溶解度都随着温度的升高而变大。
6、氢氧化钙的溶解度随着温度的升高而减小。
【习题三】
(2017秋•河北区期末)下列方法能使硝酸钾固体在水中溶解度增大的是( )
A.增加水的质量 B.增加硝酸钾的质量
C.升高溶液的温度 D.将硝酸钾固体粉碎
【考点】固体溶解度的影响因素.
【分析】溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;影响固体物质溶解度大小的因素有外因和内因,内因是指溶质的性质和溶剂的性,外因是温度;所以温度是影响溶解度大小的重要因素;气压对固体的溶解度几乎无影响。
【解答】解:A、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,溶解度不受溶剂质量多少的影响,故选项错误。
B、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,溶解度不受溶质质量多少的影响,故选项错误。
C、硝酸钾的溶解度随着温度的升高而增大,升高溶液的温度,硝酸钾的溶解度增大,故选项正确。
D、把硝酸钾粉碎,在溶解过程中不断搅拌,能加快溶解速率,不能使硝酸钾在水中的溶解度增大,故选项错误。
故选:C。
三、气体的溶解度
1、定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
2、气体的溶解度没有单位。
3、气体溶解度的影响因素:
(内因)气体的性质、水的性质;
(外因)温度、压强。
一般来说,温度越高,气体的溶解度越小;
压强越大,气体的溶解度越大。
【习题四】
(2018•静安区二模)能减少氧气在水中溶解度的方法是( )
A.升高温度 B.减少氧气的体积
C.减少水的质量 D.增大压强
【考点】气体溶解度的影响因素.
【分析】根据气体的溶解度随温度的升高而减小,随着压强的增大而增大,结合事实进行分析判断。
【解答】解:气体的溶解度随温度的升高而减小,随着压强的增大而增大,所以能减少氧气在水中溶解度的方法是升高温度或减小压强。
故选:A。
,