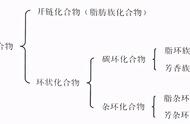
(5)相同碳原子数的有机物碳骨架的结构特点
有机物分子中可以含一个或几个碳原子,也可以含几百、几千或上万个碳原子。含有相同碳原子数的有机物,也可以因为碳原子间的成键方式不同或碳骨架不同而形成多种结构,相对应地形成多种不同的有机物。如4个碳原子可以形成以下一些基本碳骨架:

若考虑碳原子间通过双键或三键结合,将会得到更多的碳原子结合方式:

核心知识点二:
二、烷烃
1. 烷烃及烷烃的结构
(1)甲烷的组成及结构特点
在甲烷分子中,1个碳原子与4个氢原子形成4个C—H键,四个C—H键的长度和强度相同,夹角相等,其分子在空间呈四面体形结构。

空间结构:
分子结构示意图 | 结构特点及空间构型 |
4个C—H键的长度和强度相同,夹角相同,具有正四面体结构 |
【拓展】①若CH4分子中的4个氢原子全部被其他相同的原子或原子团替代,则形成的分子结构仍为正四面体结构。
②若CH4分子中的4个氢原子被其他不同的原子或原子团替代,则形成的分子结构仍为四面体,但不属于正四面体,如CH3Cl、CH2Cl2等。
③CH2Cl2只有一种结构可证明CH4、CH2Cl2等不是平面结构而是四面体结构。
④由CH4的空间结构可推知CH3CH2CH3等有机物中的碳原子并不在一条直线上。
(2)烃及烷烃
只含有碳、氢两种元素的有机化合物称为烃。
若烃分子中碳原子之间都以单键结合成链状,剩余价键均与氢原子结合,从而使每一个碳原子的化合价都达到“饱和”,这样的一类有机化合物称为饱和烃,也称为烷烃。
甲烷、乙烷、丙烷、丁烷等的分子结构均符合烷烃的概念,所以这四种有机物均属于烷烃。
(3)烷烃的结构
①烷烃的结构特点
a. 单键——碳原子之间以碳碳单键结合
b. 饱和——碳原子剩余的价键全部与氢原子结合,每个碳原子均形成4个共价键
c. 链状——碳原子结合可以形成的碳链可以是直链,也可以含有支链
②烷烃的通式
由甲烷(CH4)、乙烷(CH3CH3)、丙烷(CH3CH2CH3)的分子式或结构简式可知,碳原子数相邻的烷烃分子组成上相差一个CH2原子团,所以如果烷烃中的碳原子数为n,则其氢原子数应该为2n 2,其分子式可表示为CnH2n 2,该分子式也被称为烷烃的通式。
③结构简式
为书写方便,我们通常把结构式中的C-H键进行省略表示有机物的结构,这样的式子称为结构简式。结构简式只要把碳氢单键省略掉即可,碳碳单键、碳氯单键、碳和羟基氧形成的单键等大多数单键可以省略也可不省略。如正戊烷的结构简式为CH3CH2CH2CH2CH3,异戊烷的结构简式为CH3CH2CH(CH3)CH3,新戊烷的结构简式C(CH3)3。
2. 烷烃的性质
(1)物理性质
相似性 | 烷烃难溶于水,易溶于有机溶剂 |
液态烷烃的密度均小于1g/cm3 | |
递变性 | 烷烃的熔沸点随碳原子数的增加而逐渐升高 |
常温下,烷烃的状态随碳原子数的增加由气态变为液态,再到固态。 | |
烷烃的密度随碳原子数的增加而逐渐增大 |
烷烃分子在常温下的状态与碳原子数的关系
碳原子数 | 常温下的状态 |
1~4 | 气态 |
5~16 | 液态 |
17及以上 | 固态 |
【注意】①分子中含5个碳原子的新戊烷在常温下为气态。
②烷烃的同温异构体中,支链越多,熔、沸点越低,如戊烷同分异构体的熔沸点:正戊烷>异戊烷>新戊烷。
(2)化学性质(与CH4相似,以甲烷为例说明)
①稳定性
在通常状况下,烷烃(甲烷)性质比较稳定,与强酸、强碱或高锰酸钾等强氧化剂都不反应。
不能使溴水、酸性高锰酸钾溶液褪色。
②热分解
烷烃在较高温度下会发生分解。如甲烷能分解为单质碳和氢气,C16H34能分解为C8H18和C8H16,C4H10能分解为C2H6和C2H4等。
这个性质常被应用于石油化工和天然气化工生产中(如利用甲烷分解反应生成炭黑),从烷烃可得到一系列重要的化工原料
③可燃性
烷烃可以在空气中完全燃烧,发生氧化反应,生成二氧化碳和水,并放出大量的热。这是烷烃被用作燃料时发生的主要反应。
甲烷在空气中燃烧的化学方程式为CH4+2O2
CO2+2H2O;
现象为安静地燃烧,火焰呈淡蓝色。
【注意】相同物质的量的烷烃燃烧时,随着碳原子数的增加,耗氧量增加,若氧气不足,则燃烧不充分,易产生黑烟、CO等物质,导致燃料利用率降低。
④取代反应(以甲烷与氯气反应为例)
a. 实验探究