“漂白”这个词我们大家都很熟悉,生活中也常见,一件有颜色的东西经过漂白最后变成白色。SO2可以用来漂白,Cl2也可以用来漂白,但是漂白原理不同,漂白现象也不同。

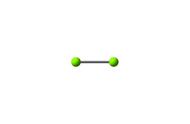
SO2是一种具有强烈刺激性气味的无色气体,分子呈V形,形成一个三中心四电子的离域π键。分子结构如下。

二氧化硫与有色物质形成无色物质,该无色物质不稳定,在一定的条件下便可以恢复为原来的颜色,例如在品红溶液中通入SO2,品红溶液便可褪色,加热到沸腾时,又重新恢复了红色。

酸性品红的结构式

而氯气起到漂白作用的并不是它本身,Cl2与水反应生成HClO,HClO具有非常强的氧化性,将有色物质氧化为无色物质,褪色以后不能恢复颜色。如果将Cl2通入到品红溶液中,品红溶液褪色后,加热到沸腾并不能恢复颜色。
那么我们把二者混合使用会不会增强其漂白性能呢?
要注意,不可以,二者结合起来反而会失去漂白能力,发生如下反应:
SO2 Cl2 2H2O===H2SO4 2HCl。
,