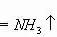化学式是《初三化学》中的重点知识,也是整个化学的关键知识。如果学生没有掌握化学式,那接下来的“化学方程式”就很难理解;酸碱盐以及有关方程式的计算知识就更难了。所以说化学式是学好化学的关键。对于初学者而言,如何正确书写出物质的化学式呢?这一问题让很多学生头疼,他们在平时没有掌握书写化学式的规律,为了应对考试只能够采取死记硬背。然而中考中涉及的物质很多,不可能一一背得出来。每年的化学中考试题中关于化学式的题目较多,占得分数比值也特别大。根据对以往全国各省化学中考试题中关于“化学式”知识点,对学生失分的原因进行深刻分析。
一、牢记元素的化合价是正确书写化学式的关键
1、必须理解元素的化合价
据科学研究统计到目前为止发现的元素大概为110多种,但是世界上的物质却有3000多万种。这么庞大物质体系都是由这仅有110来种元素组成。也就是说,一种元素会存在于很多物质中;其元素的化合价也随着它与其它元素化合的方式不同而不同。因为化合价是元素在形成化合物的时候表现出来的一种性质,也就是说一种元素可能有多种化合价,比如碳元素的化合价有 2、 4价;硫元素的化合价有三种:-2、 4、 6价;氧元素只有一种价态:-2价等。对于元素化合价,大家不要死记硬背,一定要结合原子核外电子排布情况来理解。因为元素的化合价主要是受该元素原子最外层上的电子数的影响,故元素原子最外层电子数也叫价电子数,只有这样才能更好地理解元素的化合价。
2、决定元素化合价的因素是什么
元素的化合价是其在组成化合物的时候表现出的一种性质,换句话说,就是只有化合物中的元素才有化合价,单质中元素的化合价表现为0价,因为没有与其它元素化合,所以它的化合价就是0价。元素的化合价主要体现在元素与其它元素结合的过程中得失电子或电子发生转移的情况。所以元素的化合价与该元素的原子得失电子的能力和数目有关。元素得失电子的情况主要与该元素原子的最外层电子数目密切相关。
(1)非金属元素的原子最外层电子数一般大于或等于4,在形成化合物的时候,容易得到电子成为8电子稳定结构,所以非金属元素一般显负价。比如氧元素,最外层电子数为6个,在化合的时候容易从对方原子的最外层得到2个电子,从而达到8电子稳定结构。“原子”得到2个电子后,呈电负性,负电荷比正电荷多两个;所以氧元素在化合物中一般显-2价。

图1-1氧原子的核外电子分布
(2)金属元素的原子最外层电子数一般小于4,容易失去电子成为8电子稳定结构,所以金属元素一般显正价。比如钠元素,最外层电子数为1个,在化合的过程中容易被对方原子从其最外层夺取这个电子走,这时候钠原子就会失去1个电子,从而达到8电子稳定结构。钠原子失去了1个电子后,呈电负正性,正电荷比负电荷多1个;所以钠元素在化合物中一般显 1价。下图是钠原子的核外电子排布示意图。

图1-2钠原子的核外电子分布
(3)稀有气体元素的原子最外层电子数为8或2,不容易得失电子,为稳定结构,所以稀有气体元素一般显0价。下图是氦原和氖原子的核外电子排布示意图。

图1-3氦、氖原子核外电子分布
3、牢记常见原子团的化合价
(1)首先要明白原子团的概念。
原子团是一种特殊的微粒团体,是由多个原子组合在一起的微粒,即几个原子组合的特殊团体。所以原子团具有固定的结构,不能随意认为改变。比如硫酸根(SO4)是一种常见的原子团,在很多化合物都有。它的结构是:1个硫酸根就是由1个硫原子和4个氧原子构成;硫原子与氧原子个数比为1:4,这是一个固定值。如果硫原子与氧原子个数比为1:3,那就不是硫酸根了,而是亚硫酸根,所以大家必须记住原子团中的原子个数比是一个定值,不能够随意变动。
(2)其次要能够理解原子团与酸根离子的联系与区别。
原子团是几个原子的组合原子集团,又叫根,是不带电荷的。例如碳酸根CO3,呈电中性,不带任何电荷;而离子或酸根离子是带电荷的粒子,它们所带的电荷的正负、数值与其化合价的正负、数值都相同。下图是初中化学中常见的原子团符号与对应的化合价和其离子带的电荷数情况。