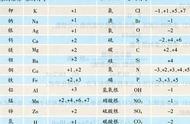
书写化学式以及氧化还原反应的配平都会用到化合价。
单质的元素化合价为零。
中学阶段,化合物的化合价的判断方法如下(有先后顺序):
1.金属的化合价都是正价,主族金属元素的主要化合价就是最外层电子数,
如锂钠钾铷铯钫 1价,铍镁钙锶钡镭 2价,铝 3价。
主族金属元素随着电子层数和最外层电子数增多,元素的化合价呈现变价,
最高价仍然等于最外层电子数,并且遵循价奇序奇,价偶序偶的原则。
如金属铊(读ta) 1 、 3价,锡铅 2 、 4价。
副族元素通常有变价,常见的有铜 1 2价,铁 2 3价,锰 2 4 6 7价,铬 3 6价,
有些也无变价,如锌 2价。
2.氢元素与金属结合(或者硼元素如NaBH4)显示-1价,如NaH,其余显 1价。
3.氟元素仅显示-1价。
4.氧元素,正常显-2价,有些时候显-1价,不好计算的时候前面的判断根据化合价的代数和等于0计算可得。如OF2中氧显 2价。
5.氮元素的化合价很多,常见的有-3, 1, 2, 3, 4, 5 。
6.硫元素的化合价也很多,常见的有-2, 2, 4, 6。
7.非金属元素的最高正价一般等于最外层电子数,并且最高正价与最低负价的绝对值之和为8。
8.有些物质同一元素有多种化合价如NH4H,Fe3O4,NH4NO3等。
9.有机物以及化合价不好判断的如Fe3C,在氧化还原反应配平中,可以认为所有元素均为零价。
,