饱和溶液与不饱和溶液
1.概念
1.溶液的定义:一种或几种物质分散在另一种物质中,形成均一、稳定的混合物叫做溶液。
2,溶液的特征
(1)均一性:是制溶液各部分组成、性质完全相同。
(2)稳定性:是指外界条件不变(温度、压强等),溶剂的量不变时,溶液长期放置不会分层也不会析出固体或气体。
饱和溶液与不饱和溶液
1.概念
(1)饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种绒织的溶液,叫做这种溶质的饱和溶液。
(2)不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
2.饱和溶液与不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,且可以相互转化:
饱和溶液降低温度或蒸发溶剂或增加溶质不饱和溶液
固体物质的溶解度以及溶解度曲线
1.概念
在一定温度下,某固体物质在100g溶剂里达到饱和状态时,所溶解溶质的质量,叫做这种物质在这种溶解里的溶解度。
2.影响固体溶解度大小的因素
(1)溶质、溶剂本身的性质
(2)温度
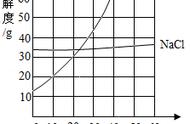
3.溶解度曲线
(1)溶解度曲线的意义
①溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
②溶解度曲线上的每一个点表示溶质在某一温度下的溶解度。此时,溶液必定是饱和溶液。
③两条曲线的交叉点表示两种物质在该温度下具有相同的溶解度。在该温度下,这两种物质的饱和溶液中溶质的质量分数相等。
④在溶解度曲线的下方的点,表示该温度下的溶液是该物质的不饱和溶液。
⑤在溶解度曲线上方的点,表示该温度下的溶液是该物质的过饱和溶液,也就是说,在溶液中存在未溶解的溶质。
(2)溶解度曲线变化的规律
大多数固体物质的溶解度随温度的升高而增大,一般表现在曲线“坡度”比较“陡”,如硝酸钾;少数固体物质的溶解度受温度的影响较小,表现在曲线的“坡度”比较“平缓”,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,表现在曲线的“坡度”下降,如熟石灰。
结晶的方法:
(1)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液又不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。适用范围:溶解度受温度变化影响不大的物质,如氯化钠。
(2)降温结晶(冷却热饱和溶液法)冷却热的饱和溶液,使溶质从溶液中结晶析出。适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
五
溶 解 度 知 识 点
概念:
1、固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数。在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
2、气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积水里的体积数。
通常把在室温(20度)下:
溶解度在10g/100g水以上的物质叫易溶物质;
溶解度在1~10g/100g水叫可溶物质;
溶解度在0.01g~1g/100g水的物质叫微溶物质;
溶解度小于0.01g/100g水的物质叫难溶物质.
可见溶解是绝对的,不溶解是相对的。
影响溶解度大小的因素;
物质溶解与否,溶解能力的大小,一方面决定于物质的本性;另一方面也与外界条件如温度、溶剂种类等有关。在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同。通常把某一物质溶解在另一物质里的能力称为溶解性。例如,糖易溶于水,而油脂不溶于水,就是它们对水的溶解性不同。溶解度是溶解性的定量表示。
气体的溶解度还和压强有关。 压强越大,溶解度越大,反之则越小;温度越高,气体溶解度越低。
溶解度曲线:
1点
溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。
2线
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
根据溶解度曲线,选择分离某些可溶性混合物的方法。
3交点
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
大部分固体随温度升高溶解度增大,如硝酸钾;少部分固体溶解度受温度影响不大,如食盐;极少数物质溶解度随温度升高反而减小,如氢氧化钙。
>>>>例题解析(供参考)
一、灵活应用溶解度概念知识解题
【例1】在t1℃时,20克水中最多能溶解15克X,t2℃时50克水中最多能溶解30克Y物质。则X和Y两种物质的溶解度的关系是
A.X>Y B.X<y C.x=Y D.无法确定
【解析】依题意知:本题对溶解度的概念进行了另一种较为抽象的理解,即在一定量的溶剂中最多溶解某物质的质量,说明该溶液已经达到饱和.按照溶解度的定义计算:X物质的溶解度应为:15克/20克×100克==75克;Y物质的溶解度应为:30克/50克×100克==60克.值得注意的是如果本题不对溶解度的定义进行深层次的理解,容易误选A选项.由于X和Y两物质所对应的温度不相同,故溶解度是无法进行比较的.故本题的答案为:D.
【例2】某温度下,将A物质(不含结晶水)的水溶液分成等质量的2份。向第一份加入9克A物质,充分搅拌,还有1克固体不能溶解;将第二份溶液蒸发掉40克水,并恢复到原温度,溶液恰好饱和(无A析出),则A物质在该温度下的溶解度是
A.40克 B.20克 C.8克 D.无法计算
【解析】由题意分析可知:本题含有两个隐含条件:(1)分成两等份的溶液中蒸发掉40克水都恰好能形成饱和溶液(2)蒸发掉40克水恰好能溶解9-1==8克A物质。因此原题意可以转化为:某温度下,8克A物质(不含结晶水)溶解在40克水中恰好形成饱和溶液,试求A物质在该温度下的溶解度。显然,经过题意转化后给解题带来了很大的方便。直接求出答案为:8克/40克 ×100克==20克。
故本题的答案为:B。

二、灵活应用溶液组成知识解题
【例】要使A克质量分数为20%的食盐溶液变为质量分数为10%的溶液,可以采用的方法是
A.加入0.8A克水 B.加水使溶液的质量为2A
C.蒸发水,析出0.1A克固态食盐
D.加入2A克质量分数为5%的食盐溶液
【解析】本题是考查关于溶液组成知识的一道综合性较强的试题。解答本题的关键在于充分理解和应用溶质质量分数的定义。
对于A:加入0.8A后溶液中溶质的质量分数为:(A×20%)/(A 0.8A)==11.1%
对于B:加入水后溶液中溶质的质量分数为: (A×20%)/2A==10%
对于C:蒸发水,析出0.1A克固态食盐后溶质的质量变为原来的一半,但溶液的质量变为A-0.1A==0.9A,故溶液中溶质的质量分数一定大于10%
对于D:加入2A克质量分数为5%的食盐溶液后溶质的质量分数为:
(A×20% 2A×5%)/(A 2A)==10%
综合以上分析得:答案为B、D。
三、灵活运用溶解度概念
解决结晶问题的计算
【例】A、B两种化合物的溶解度曲线如图所示。现要用结晶法从A和B的混合物中提取A(不考虑A、B共存时对各自溶解度的影响)。
(1)取50克混合物,将它溶于100克热水,然后冷却到20℃。若要使A析出而B不析出,则混合物中B的质量分数(B%)最高不能超过多少?(写出推理及计算过程)
(2)取W克混合物,将它溶于100克热水,然后冷却到10℃,若仍然要A析出而B不析出,请写出在这两种情况下混合物中A的质量分数(A%)应该满足的关系式(以W,a,b表示,只需将答案填在横线上)
当W<a b 时, A%
当W>a b时, A%

【解析】(1)在20℃时,若要使B不析出,该溶液中B的质量不能超过20克.由于A和B的质量总和为50克,所以此时A的质量超过30克,大于其溶解度,A析出,符合题意.
即50克×B%≤20克,即得: B%≤40% 或 B%<40%.
(2)要使A析出而B不析出,至少要满足:A%==a/(a b),因为W<a b,则A%>a/W;
而当W>a b时,则a<W-b,则有A%≥(W-b)/W 或 A%>(W-b)/W.
四、溶解度和溶液组成知识的综合应用
【例】某物质在20℃时的溶解度为20克,在20℃ 时将该物质20克投入80克水中充分溶解,则该物质溶液中溶质的质量分数为
A.25% B.20% C.16.7% D.无法计算
【解析】本题是一道溶解度和溶质质量分数的简单综合计算题,也是一道容易错解的试题。依题意知首先必需依据溶解度计算出80克水中最多溶解溶质的质量:(设最多溶解的质量为X)则有X/80克==20克/100克 X==16克,然后依据溶质的质量分数的定义计算得:
16克/(16克 80克)×100%==16.7%
,