溶解度曲线及其应用,近年来作为中考化学常考的必考题型之一。小编通过搜集资料将大概的解题思路整理分享给各位中考的同学们。争取在中考的“战场”上多一份自信,少一分遗憾。
解题思路一、正确理解溶解度的含义
1.点
(1)曲线上的每一点表示物质在该点对应的温度下的溶解度。
(2)两条曲线的交点表示两物质在该点所对应温度下的溶解度相等。
2.线:表示物质的溶解度随温度变化的情况。
(1)陡升型:大部分固体物质,其溶解度受温度变化影响较大,如KNO3。
①从溶液中提纯该物质的方法为冷却热饱和溶液,即降温结晶。
②饱和溶液与不饱和溶液的相互转化方法:

(2)缓升型:少数物质,其溶解度受温度变化影响较小,如NaCl。
①从溶液中提纯该物质的方法为蒸发溶剂。
②饱和溶液与不饱和溶液的相互转化方法:

(3)下降型:极少数物质的溶解度随温度升高反而减小,如熟石灰。
①从溶液中提纯该物质的方法为升温结晶。
②饱和溶液与不饱和溶液的相互转化方法:

3.面
(1)曲线下方的平面上的点为对应温度下该物质的不饱和溶液。
(2)曲线.上方的平面上的点为对应温度下该物质的过饱和溶液。
二、分析题干、图表信息
(1)分析题干信息、图表的信息,提取已知信息,如溶解度曲线随温度的变化情况、饱和溶液与不饱和溶液的转化、不同温度下的溶解度等。
(2)结合对溶解度意义的理解,根据已知信息分析问题。
(3)解答每一问时,注意是否有增加其他前提条件。
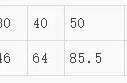
中考典例真题(2019 广东)如图所示是三种物质的溶解度曲线图请回答:
(1)溶解度随温度升高而降低的是 ;30℃时溶解
度最大的是 。
(2)80℃时硝酸钠饱和溶液质量分数为 ;使硝酸钠不饱和溶液变为饱和溶液,可采用的措施 (写一种)
(3)某硝酸钾固体混合物中含有少量硫酸鈰杂质,分离提纯硝酸钾的操作是配置成高温下的硝酸钾饱和溶液、 、过滤、洗涤、干燥。

(1)由图表可以明显直观的反映出答案。
(2)解此题之前需要明白溶解度的具体概念。
溶解度:在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质质量。换句话说:温度一定,某固态物质的溶解度一定。
由图表可知80℃硝酸钠溶解度为150g。则溶质质量为150g。溶液质量为250g。所以溶质质量分数为150g/250g*100%=60%。硝酸钠溶解度曲线属于陡升性。由不饱和溶液变为饱和溶液的方法有:减少溶剂、加溶质、降温三种方法。
(3)由图可知,硝酸钾和硫酸鈰溶解度是随温度升高或降低溶解度变化截然相反。分离提纯的方法是冷却热饱和溶液法。
冷却热饱和溶液的步骤:加热溶解、降温结晶、过滤、洗涤、干燥。
,