(1)铝灰中氧化铝与硫酸反应的化学方程式为___________________________________。
(2)图中"滤渣"的主要成分为________(填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为_______________________________。
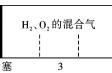
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4eq \o(========,\s\up7(1 240 ℃),\s\do5( ))2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是____________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________(填化学式)。
③KMnO4溶液褪色(MnOeq \o\al(-,4)被还原为Mn2+),发生的离子反应方程式为_______________。
3.(2016届潍坊模拟)某兴趣小组设计如图装置制取SO2,研究其性质,并进一步探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。

(1)仪器G的名称是________________。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则C中反应的离子方程式为_______,证明SO2有氧化性的实验现象是________________。
(3)为了实现绿色环保的目标,某同学设计装置F来代替装置A。与装置A相比,装置F的优点是__________________________________(写出2点)。
(4)若选用装置F制取O2,可选用试剂________________。
(5)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。

已知:SO3遇水剧烈反应,放出大量热。产生酸雾:98.3%的H2SO4可以吸收SO3和酸雾。供选试剂:蒸馏水、0.5 mol·L-1BaCl2溶液、98.3%的H2SO4、2.0 mol·L-1 NaOH溶液、KMnO4溶液。①c中应选用的试剂是______________,e中试剂的作用是________,f中收集的气体是____________。②某同学提出用饱和NaHSO3溶液代替98.3%的H2SO4,请你评价该方案是否可行,若可行不必说明理由,若不可行,简述其理由______________________。
4.(2017届福建漳州八校高三联考)已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强,它可用于制备苯甲酸乙酯。制备的反应原理如下: