硅
1. 物理性质
带有金属光泽的灰黑色固体,硅的空间结构与金刚石类似,都有正四面体型的空间网状结构,熔点高,硬度大,有脆性,处于金属和非金属的过渡位置,导电性介于导体和绝缘体之间,是良好的半导体材料,硅分为晶体和无定形两种
2. 化学性质
在常温下化学性质不活泼
(一)常温下的反应
(1)硅与氟气反应
Si 2F2 = SiF4
(2)硅与氟化氢反应
Si 4HF = SiF4↑ 2H2↑
(3)硅与氢氧化钠反应
Si 2NaOH H2O = Na2SiO3 2H2↑(氧化剂是水)
(二)加热或者高温条件下的反应
(1)硅与氯气反应
Si 2Cl2 = SiCl4(条件:加热)
(2)硅与氧气反应
Si O2 = SiO2(条件:加热)
(3)硅与碳反应
Si C = SiC(条件:高温)
碳化硅(俗称:金刚砂,砂轮的主要成分)
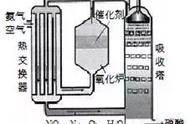
3. 硅的工业制法
方法一
SiO2 2C = Si 2CO↑(条件:高温)
(粗硅)
Si 2Cl2 = SiCl4(条件:加热)
SiCl4 2H2 = Si 4HCl(条件:高温)
(精硅)
方法二
石英砂与焦炭反应生成粗硅
SiO2 2C = Si 2CO↑(条件:高温)
粗硅与氯化氢反应生成三氯硅烷
Si 3HCl = SiHCl3 H2↑(条件:加热)
三氯硅烷与氢气生成高纯硅
SiHCl3 H2 = Si 3HCl(条件:高温)
4. 硅的用途
(1)半导体材料,制硅芯片
(2)制造光电池,将光能直接转化为电能
,