⒌ 有关溶解度的计算公式(溶质为不含结晶水的固体)
⑴ 基本公式:
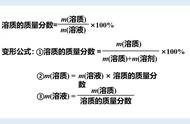
一定温度下,某饱和溶液中溶质B的溶解度(S)与溶质B的质量分数ω(B)的换算公式:
①溶解度(g)÷100(g)=饱和溶液中溶质的质量(g)÷溶剂质量(g)
②溶解度(g)÷[100(g)+溶解度(g)]=饱和溶液中溶质的质量(g)÷饱和溶液的质量(g)
⑵ 相同温度下,溶解度(S)与饱和溶液中溶质的质量分数(w%)的关系:
S(g)=w(g)÷(100−w)(g)=100(g)
w%=S(g)÷(100 S)(g)×100%
或S=100×w(B)/1-w(B)
⑶ 温度不变,蒸发饱和溶液中的溶剂(水),析出晶体的质量m的计算:
m=溶解度(g)÷100(g)×蒸发溶剂(水)的质量(g)
⑷ 降低热饱和溶液的温度,析出晶体的质量m的计算:
m=(高温溶解度−低温溶解度)÷[100 高温溶解度](g)×高温原溶液质量(g)
⒍ 化学反应速率的计算公式
⑴ 某物质X的化学反应速率:
υ(x)=X的浓度变化量(mol/L)÷时间变化量(s或min)
⑵ 对于下列反应:
mA nB=pC qD
有v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
或v(A)÷m=v(B)÷n=v(C)÷p=v(D)÷q

⒎ 化学平衡计算公式
对于可逆反应:mA(g) nB(g)=pC(g) qD(g)
⑴ 各物质的变化量之比=方程式中相应系数比
⑵ 反应物的平衡量=起始量-消耗量
生成物的平衡量=起始量+增加量
表示为(设反应正向进行):
mA(g)+nB(g) = pC(g)+qD(g)
起始量(mol) a .....b........c .....d
变化量(mol) x(耗)...nx/m(耗)....px/m(增)qx/m(增)
平衡量(mol) a-x b-nx/m c px/m d qx/m
⑶ 反应达平衡时,反应物A(或 B)的平衡转化率(%)
=A(或B)的消耗浓度(mol/L)÷A(或B)的起始浓度×100%
=A(或B)消耗的物质的量(mol)÷A(或B)起始的物质的量(mol)×100%
=气体A(或 B)的消耗体积(mL或L)÷气体A(或B)的起始体积(mL或L)
说明: 计算式中反应物各个量的单位可以是mol/L、mol,对于气体来说还可以是L或mL,但必须注意保持分子、分母中单位的一致性。
⒏ 某一反应物的平衡转化率
=(指定反应物的起始量—指定反应物的平衡量)÷指定反应物的起始量×100%
=指定反应物达平衡时的消耗量÷指定反应物的起始量×100%
⒐ 元素的相对原子质量的求法
设某元素有A、B、C三种同位素,其相对原子质量分别为Ar(A)、Ar(B)、Ar(C),它们的原子的质量分数分别为a%、b%、c%,则:
该元素的相对原子质量
=Ar(A)×a%+Ar(B)×b%+Ar(C)×c%
⒑ 一定温度下,水的离子积Kw的计算公式
Kw= C(H )×C(OH-)
25℃时Kw=1×10-14

⒒ 溶液的pH值计算公式
⑴ 溶液的pH与溶液中氢离子浓度c(H )的换算公式
pH=−lg[(cH )]或c(H )=10-pH
若(cH )=10-nmol/L,则pH=n
若(cH )=m×10-nmol/L,则pH=n-lgm
⑵ 任何水溶液中,由水电离产生的(cH )与(cOH-)总是相等的,即:
c水(H )=c水(OH-)
⑶ 常温(25℃)时:(cH )×(cOH-)=1×10-14
⑷ n元强酸溶液中(cH )=nc(酸);n元强碱溶液中(cOH-)=nc(碱)
⒓ 有关物质结构,元素周期律的计算公式
⑴ 原子核电荷数、核内质子数及核外电子数的关系
核电荷数=核内质子数=原子核外电子数
注意:阴离子:核外电子数=质子数+所带的电荷数
阳离子:核外电子数=质子数-所带的电荷数
⑵ 质量数(A)、质子数(Z)、中子数(N)的关系
A=Z N
⑶ 元素化合价与元素在周期表中的位置关系
① 对于非金属元素:最高正价+|最低负价|=8(对于氢元素,负价为-1,正价为 1)。
②主族元素的最高价=主族序数=主族元素的最外层电子数。

⒔ 反应热与反应物、生成物的键能关系
⊿H=生成物键能的总和-反应物键能的总和
⒕ 烃的分子式的确定方法
⑴ 先求烃的最简式和相对分子质量,再依(最简式相对分子质量)n=相对分子质量,求得分子式。
⑵ 商余法:
烃的相对分子质量÷12→商为C原子数,余数为H原子数。
注意:一个C原子的质量=12个H原子的质量
⒖ 依含氧衍生物的相对分子质量求算其分子式的方法
CxHyOz=(M-z×16)÷12,所得的商为x,余数为y。
注意: 1个CH4 原子团的式量=1个O原子的相对原子质量=16
(M −10)÷14
除尽……酚(商为碳原子数)
余6……醛(商为碳原子数)
余8……醇或羧酸(羧酸比商少一个碳原子)