知识点1.中和反应及其应用
【知识点的认识】中和反应是指酸与碱作用生成盐和水的反应.其实质是酸溶液中的H 和碱溶液中的OH﹣结合生成水(H₂O).如图所示:

常见的中和反应有:
NaOH HCl=NaCl H2O、
2NaOH H2SO4=Na2SO4 2H2O、
Ca(OH)2 2HCl=CaCl2 2H2O、
Ca(OH)2 H2SO4=CaSO4 2H2O、
H2SO4 Ba(OH)2=BaSO4↓(白色沉淀,不溶于硝酸) 2H2O.
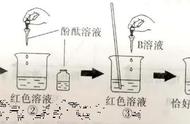
具体的操作步骤:以在氢氧化钠溶液中加入盐酸为例,如图所示:

也就是,首先在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞试液(使溶液成红色),再用胶头滴管慢慢地向其中滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止.其中,酚酞试液的作用是根据酚酞的颜色逐渐变浅至消失,既可以说明中和反应的进行,也可以说明反应的完全;但是不可说明是否滴入过多的酸性溶液而使试液呈酸性(因为酚酞溶液无法使酸性溶液显色).其实,检测中和反应是否在进行(或是否完全)的方法,除此之外还有很多.例如:
1.用pH试纸来检测:一般在中和反应进行时,反应前后溶液的pH会变化.用pH来检测中和反应是否进行是最直接的方式.
2.用探测温度的方法:一般来说,中和反应都是放热的反应(但是放热反应不一定是中和反应,如燃烧等).所以,可以通过探测溶液的温度是否升高,来推断中和反应的进行和完全.
至于中和反应的应用,主要有如下四点:
1.改变土壤的酸碱性:根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性,利于植物生长.例如,近年来由于空气污染造成酸雨,还有有机物在分解的过程中会生成有机酸,并且矿物的风化也可能产生酸性物质,导致一些地方的土壤呈酸性,不利于作物的生长;于是人们将适量的熟石灰撒入土壤中,以中和其酸性.同时,促进微生物的繁殖,并且土壤中的钙离子增加后,能促使土壤胶体凝结,有利于形成团粒,还可供给植物生长所需的钙元素.
2.处理工厂的废水:工厂里的废水常呈现酸性或碱性,若直接排放将会造成水污染,所以需进行一系列的处理.碱性污水需用酸来中和,酸性污水需用碱来中和.例如,硫酸厂的污水中含有硫酸等杂质,可以用适量的熟石灰来进行中和处理(生成硫酸钙沉淀和水).
3.用于医药:人的胃液里含有适量的盐酸(即胃液的pH值为0.9~1.5),可以帮助消化食物;但是如果饮食过量时,胃会分泌出大量胃酸,反而造成消化不良,会使人感到不适,这时医生就会让你口服一些碱性药物,使碱与过多胃酸反应生成无毒的中性物质.例如,用含氢氧化铝的药片可治疗胃酸过多,生成氯化铝和水. 另外,被蚊虫叮咬后,蚊虫能在人的皮肤内分泌出蚁酸,从而使皮肤肿痛.如果在患处涂一些含有碱性物质(如NH3•H2O)的药水,来中和蚊虫分泌出的蚁酸,就可减轻痛痒.
4.调节溶液酸碱性:在科学实验时,经常要把溶液的pH控制在一定范围内,如果溶液的酸性或碱性太强,就可以用适当的碱或酸调节溶液的pH.
【命题方向】该考点的命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对中和反应及其应用的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力.并且,经常将其与“酸碱指示剂及其性质、酸的化学性质及其用途、碱的化学性质及其用途、溶液pH的测定、化学反应时的能量变化、复分解反应及其发生的条件、物质的推断和鉴别、化学方程式的书写、有关实验操作(或现象、结论)”等相关知识联系起来,进行综合考查.当然,有时也单独考查之.题型有选择题、填空题、实验探究题和计算题.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,对中和反应及其应用等相关知识的理解和掌握情况,以及运用它们来分析、解答相关的实际问题的能力等.当然,有时还会根据所给的有关的表达,来评价表达的正误,或者注意事项等.特别是,对中和反应的定义及其操作过程(包括判断反应是否进行和完全)、有关的反应现象及化学方程式的书写、前三个应用,以及知识的迁移能力的考查,是近几年中考命题的热点,并且还是中考考查这块知识的重中之重.
【解题方法点拨】要想解答好这类题目,首先,要理解和熟记中和反应及其应用等相关知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.同时,还需要注意以下三点:
1.中和反应是指酸与碱作用生成盐和水的反应.但是,不能反过来说生成盐和水的反应是中和反应.因为非金属氧化物与碱作用也能生成盐和水(如二氧化碳与澄清的石灰水的反应),可它就不是中和反应;还有酸与金属氧化物作用也能生成盐和水(如用稀盐酸出铁锈的反应),可它也不是中和反应.
2.中和反应一定是复分解反应,但是复分解反应不一定是中和反应;只有酸和碱之间的反应才是中和反应.
3.在做中和反应的实验时,由于酸和碱的溶液一般是无色,二者反应时的现象不明显,所以往往借助于一些试剂或仪器等(如酸碱指示剂、pH试纸、温度计等),来帮助我们判断反应是否进行或恰好完全.
知识点2.溶液的酸碱性与pH值的关系
【知识点的认识】溶液的酸碱性与pH值的关系,如图所示:

其具体内容是酸性溶液的pH值<7;中性溶液的pH值=7;碱性溶液的pH值>7.可简记:“小酸大碱中7”;其含义是:“pH值<7为酸性,pH值>7为碱性,pH值=7为中性.”并且其中的“小酸大碱”还可暗示:“pH值越小,溶液的酸性越强;pH值越大,溶液的碱性越强.”
【命题方向】该考点的命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对溶液的酸碱性与pH值的关系的理解和掌握情况,或者是解答与之相关问题的能力等.命题方式是根据溶液的酸碱性来推断其pH值大小,或者是根据溶液的pH值大小来推断其酸碱性强弱,有时对给出的有关表达进行判断或评价,有时还要求进行误差分析,等等.题型有选择题、填空题和实验探究题.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,以及对溶液的酸碱性与pH值的关系的理解和掌握情况.特别是,对溶液的酸碱性与pH值的关系的应用能力和知识的迁移能力的考查,是近几年中考的热点,当然,也是中考考查这块知识的重中之重.
【解题方法点拨】要想解答好这类题目,首先要理解和熟记溶液的酸碱性与pH值的关系等相关知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求对症下药,进行认真地选择或解答即可.
知识点3.溶液的酸碱性测定
【知识点的认识】溶液的酸碱性测定方法有很多种,最常用的是使用酸碱指示剂和pH试纸来,进行判断.具体判断方法如下:
1.使用酸碱指示剂的方法:
首先,取少量的待测溶液与试管中,然后,向其中滴加几滴紫色的石蕊试液,振荡;如果溶液变成红色,那么该溶液就显酸性;如果溶液不变色,那么该溶液显中性;如果溶液变成蓝色,那么该溶液显碱性.同理,可以向待测溶液中滴加无色的酚酞试液来测定;但是,此时只能测定出溶液的碱性(使酚酞试液变成红色的),而不能测定出溶液的酸性或中性(因为酚酞试液在酸性或中性溶液中都是无色的).
2.使用pH试纸的方法:
首先,用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上;然后,再把试纸显示的颜色与标准比色卡做比较,即可得出待测溶液的pH.当pH值<7时,该溶液为酸性;当pH值=7时,该溶液为中性;当pH值>7,该溶液为碱性.
另外,还可以根据酸或碱的其它的化学性质来测定酸溶液或碱溶液的酸碱性.例如,向某溶液中插入铁丝时,如果有气泡冒出,那么该溶液为酸溶液;等等.
【命题方向】该考点的命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对溶液的酸碱性测定方法的理解和掌握情况,以及对溶液的酸碱性测定的实验方案的设计、实验操作及其注意事项、溶液的酸碱性与pH值的关系、酸碱指示剂及其性质、酸碱的化学性质等相关问题的分析、推断、表达的能力和对知识的迁移能力等.并且,经常将其与这些相关知识等关联起来,进行综合考查.命题方式就是结合着这些相关知识等来设计相应的综合性题目,让学生通过分析、推断和探究,来选择或解答有关溶液的酸碱性测定的实际问题,有时根据溶液的酸碱性测定方法来推断溶液的酸碱性,有时对给出的有关表达进行科学地判断或评价,等等.题型有选择题、填空题和实验探究题.中考的重点是考查学生阅读、分析实验、问题情景或图表信息的能力,以及对溶液的酸碱性测定方法的理解和掌握情况.特别是,对溶液的酸碱性测定的实验方案的设计、实验操作和注意事项的考查,以及知识的迁移能力的考查,是近几年中考的热点,当然,也是中考考查这块知识的重中之重.
【解题方法点拨】要想解答好这类题目,首先要理解和熟记溶液的酸碱性的测定方法等相关知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或实验、图表信息)等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求对症下药,进行认真地选择或解答即可.
一、中和反应及其应用
1、两个概念
中和反应:酸和碱作用生成盐和水的反应。
盐:由金属离子和酸根离子构成的化合物。
2、中和反应的理解
(1)中和反应是酸和碱之间发生的反应,反应后一定生成盐和水,但是生成盐和水的反应却不一定是中和反应。如氢氧化钠与二氧化碳反应生成氯化钠(盐)和水,但不是中和反应。
(2)酸和碱反应时,反应现象常常不明显,要先在氢氧化钠溶液中滴加几滴酚酞,然后再滴加盐酸,在滴加盐酸时要边滴加边振荡,直至红色刚好褪去,利用酚酞在碱性时变为红色,中性时为无色来判断反应是否恰好完成。
3、中和反应的应用
主要利用中和反应后改变了溶液的酸碱性。如酸性土壤中加入熟石灰使土壤酸性降低,利于农作物生长。胃酸的主要成分为盐酸,胃酸过多的的病人可服用一些碱性药物(如胃舒平的主要成分为氢氧化铝)来中和过多的胃酸。
二、溶液酸碱度的表示方法——pH
1、溶液酸碱性的强弱程度叫溶液的酸碱度,常用pH来表示。
2、pH与溶液酸碱性的关系
当pH=7时,溶液为中性;当pH>7时,溶液为碱性;当pH<7时,溶液为酸性。
pH越小,溶液的酸性越强;pH越大,溶液的碱性越强。
3、测定方法
用玻璃棒蘸取待测溶液滴到pH试纸上,与标准比色卡比较,得到溶液的pH,此法测得的pH为整数。
(1)不能将pH试纸直接浸入待测溶液中,以免带入杂质。
(2)不能将pH试纸湿润,否则会使测得的pH不准确(若是酸性溶液,测得值偏大;若是碱性溶液,测得值偏小)。
(3)检验气体的酸碱性时,可将试纸湿润后再用。
4、了解溶液酸碱度的意义
(1)化工生产中许多反应必须在一定pH的溶液中才能进行。
(2)农作物一般适宜在pH为7或接近7的土壤中生长。
(3)测定雨水的pH,了解空气的污染情况。
(4)测定人体内或排除的液体的pH,可以了解人体的健康状况。
5、几个注意点
(1)注意酸碱性与酸碱度的区别:溶液的酸碱性是指溶液是酸性还是碱性,常用酸碱指示剂来检验溶液的酸碱性。溶液酸碱性的强弱程度叫溶液的酸碱度,测定溶液的酸碱度常用pH试纸。
(2)要使酸性溶液的pH升高,可向溶液中加入碱性溶液;要使碱性溶液的pH降低,可向溶液中加入酸性溶液。稀释酸性或碱性溶液时,酸性溶液的pH会变大并接近7,但不会等于或大于7;碱性溶液的pH会变小并接近7,但不会等于或小于7。
(3)酸溶液一定显酸性,但是显酸性的溶液不一定是酸溶液,如NaHSO4的水溶液就是酸性溶液;碱溶液一定显碱性,但是显碱性的溶液不一定是碱溶液,如Na2CO3的水溶液就是碱性溶液。
,