(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是____________________________。
(2)待装置冷却一段时间后,打开K2,如果观察到____________________________________,说明空气中氧气的体积约占eq \f(1,5),若实验测得空气中氧气的体积分数小于eq \f(1,5),原因可能是__________________(答一条即可)。
[实验二]
用如图Z1-12所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量。

若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________[已知:铜能与
空气中氧气、水、二氧化碳反应生成铜绿,化学方程式为:2Cu+O2+H2O+CO2===Cu2(OH)2CO3]。
10.[2017·丽水]小峰和小刚阅读试剂标签后发现,市场销售的高锰酸钾晶体纯度高达99.5%,含水量可以忽略不计。为探究"试管放置方式对高锰酸钾制取氧气速度和体积的影响",他俩设计了制取氧气的直立型装置,并与斜卧型装置比较(如图Z1-13所示),在气密性良好的装置中分别加入5.0克高锰酸钾晶体,用相同酒精灯分别加热,用同一型号的集气瓶收集气体,每组实验进行五次,实验数据取平均值后记录如下表:

(1)收集2瓶氧气,所需时间较短的装置类型是________。
(2)等质量的高锰酸钾加热到不再产生气体,斜卧型装置收集到氧气的总体积比直立型少的原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)根据2KMnO4eq \o(=====,\s\up7(△))K2MnO4+MnO2+O2↑,算出5.0克高锰酸钾生成的氧气体积为理论值,实验中发现斜卧型发生装置收集到的氧气体积明显大于理论值,他们对其原因进行了探究:
[提出假设]
小峰假设:反应生成的二氧化锰在较高温度下受热分解放出氧气;
你的假设:________________________________________________________________________。
[设计实验]要验证小峰的假设能否成立,请设计简明的实验方案:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
11.[2017·襄阳]把干燥、纯净的氯酸钾和二氧化锰的混合物31.5 g装入大试管中,加热制取氧气。待完全反应后,将试管冷却、称量,得到21.9 g固体物质。计算制得氧气多少克?21.9 g固体物质中含有哪些物质?各多少克?
参考答案
|夯实基础|
1.A 2.D
3.C [解析] 氮气和稀有气体通常情况下化学性质稳定,不易与其他物质发生化学反应,二氧化碳常温条件下也不与食物作用,氧气通常状况下能与食物发生氧化反应。
4.A [解析] 空气污染物包括有害气体和粉尘,有害气体为二氧化硫、二氧化氮、一氧化碳,PM2.5属于可吸入颗粒物,是空气污染物;二氧化碳不属于空气污染物。
5.B
6.A [解析] 空气是由氧气、氮气、稀有气体、二氧化碳等气体组成的混合物。
7.D [解析] 细铁丝在氧气中燃烧生成四氧化三铁,而非氧化铁。
8.B [解析] 硫在氧气中燃烧发出明亮的蓝紫色火焰;铁在氧气中剧烈燃烧,火星四射,生成黑色固体,同时放热;红磷燃烧产生大量的白烟,生成五氧化二磷是结论,而非现象;木炭在空气中燃烧发出红光,放热,不产生火焰。
9.B
10.B [解析] O2的化学性质比较活泼,具有助燃性,不是可燃性。
11.C [解析] 硫燃烧会生成气体二氧化硫,从而占据所消耗氧气的体积,故该实验中的红磷不可以用硫来代替。
12.(1)2H2O2eq \o(=====,\s\up7(MnO2))2H2O+O2↑
(2)AB (3)铁架台 (4)f 洗涤干燥 纱布
(5)MnO2作为催化剂,化学反应前后质量和化学性质不变
[解析] (2)制取氧气时,用注射器加入过氧化氢溶液的优点是便于控制反应,便于定量添加药品。(3)实验完毕后,只有二氧化锰难溶于水,故可以采用过滤的方法进行分离,过滤操作需用仪器除烧杯、漏斗、玻璃棒外,还需要用铁架台固定。(4)过滤时用于引流的玻璃棒的末端要轻轻地斜靠在三层滤纸的一边;过滤出来的固体要经过干燥除去水分;生活中可以代替滤纸作为分离固体和液体的物品为纱布等。(5)二氧化锰在过氧化氢分解的反应中作为催化剂,反应前后化学性质和质量不变,因此可以重复使用。
13.(1)锥形瓶
(2)2KClO3eq \o(=====,\s\up7(MnO2),\s\do5(△))2KCl+3O2↑
分解反应 防止水倒吸使试管炸裂
(3)增多 增大 大于 氧气不易溶于水,也不与水反应
(4)将带火星的木条放在集气瓶口,若木条复燃,则说明氧气已收集满
(5)伸入液面以下
|能力提升|
1.B 2.B
3.D [解析] 该装置集氧气的制取和铁丝在氧气中的燃烧装置于一体,所以氧气无须提前制备和收集;如果塑料瓶炸裂,塑料瓶的材质轻,破坏力小,用塑料瓶代替集气瓶,实验更安全;二氧化碳和氢气的制取也用固液常温型发生装置,也能用浓硫酸干燥,当将水换成澄清石灰水时能检验二氧化碳,将铁丝换成燃着的木条能检验氢气。
4.A [解析] 该实验是在常温下进行的,广口瓶底部不用放少量水;通过分析本次实验数据,可知空气中氧气的体积分数约为eq \f(48 mL,242 mL)×100%≈19.8%;若实验药品充足,时间足够长,广口瓶内空气中的氧气会被完全消耗,可十分接近拉瓦锡实验的结果;此实验没有使用金属汞,所以可有效解决拉瓦锡实验中的汞污染问题。
5.B [解析] H2O2溶液的质量是一定的,当过氧化氢完全分解后,氧气质量不再变化;过氧化氢分解生成水,溶剂质量增加,完全反应后,溶剂质量不再变化;随着过氧化氢的分解,过氧化氢的质量分数逐渐减小,完全反应后,过氧化氢的质量为零,质量分数为零;FeCl3是催化剂,反应前后质量不变,过氧化氢分解为氧气和水,溶剂质量增大,FeCl3的质量分数变小,完全反应后,溶剂和FeCl3质量均不变,FeCl3质量分数也不变。
6.(1)2H2O2eq \o(=====,\s\up7(MnO2))2H2O+O2↑(合理即可)
(2)产生明亮的蓝紫色火焰,放热,有刺激性气味的气体生成 都是氧化反应(或都放出热量,合理即可)
(3)正:支持燃料燃烧,提供能量;反:铁生锈,浪费金属资源(合理即可)
7.(1)催化作用 (2)d→e→b(→c) (3)①②④
8.(1)锥形瓶
(2)2KMnO4eq \o(=====,\s\up7(△))K2MnO4+MnO2+O2↑
分解反应 C 集气瓶口是否有大气泡冒出
(3)BFD
(4)②③
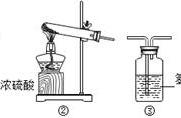
[解析] (3)实验室常用大理石和稀盐酸常温下反应制取二氧化碳,故应该选择B作为反应的发生装置;二氧化碳密度比空气的大,故应该用向上排空气法收集,用盐酸制取的二氧化碳中含有水蒸气,故应该通过浓硫酸干燥,再用向上排空气法收集,所以连接顺序是BFD。(4)①不易溶于水或者难溶于水的气体可以用F装置收集,因为气体的密度都小于水的密度,故气体都由短管进入,即由b管通入气体,随着气体增多将水从a管排出,故①错误;②当装置内盛满氧气时,若将装置内的氧气排出来,水从a通入,氧气由b管排出,故②正确;③当装置内盛有一半水时,a端连氧气钢瓶,产生气泡速率快则说明氧气通入速率快,因此可观察给病人输氧气的速率,故③正确。
9.[实验一] (1)温度需达到可燃物的着火点
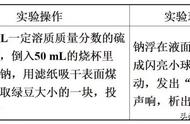
(2)量筒中的水进入A中的体积为40 mL 温度未冷却至常温就打开弹簧夹(或白磷的量不足等)
[实验二] 不能,空气中二氧化碳含量只有0.03%,而铜生成铜绿时,不能完全消耗空气中的氧气
[解析] [实验一] (1)白磷在常温下的空气中不能燃烧,在80 ℃的空气中能燃烧,说明可燃物燃烧时温度需达到其着火点。(2)待白磷燃烧完毕,冷却一段时间后,打开K2,则由于装置内气压降低,量筒中的水会进入A中,若量筒内水能进入瓶中40 mL(200 mL×eq \f(1,5)=40 mL),则可证明空气中氧气含量约为空气总体积的五分之一;若测得空气中氧气含量小于五分之一,则可能是因为装置温度未降至常温就打开弹簧夹或燃烧匙内的白磷量不足,没有将装置内的氧气完全消耗。[实验二] 用铁丝生锈的原理也可测定空气中氧气的含量,但不能用铜生成铜绿的方法测定,原因是空气中氧气含量远大于二氧化碳,故试管内没有足量的二氧化碳与铜发生反应生成铜绿,即该反应不能完全消耗试管中的氧气,不能准确测定空气中氧气的含量。
10.(1)直立型 (2)斜卧型装置中,加热时,高锰酸钾粉末随气流带到试管口附近或试管口的棉花团上的比直立型试管中的多,即没有分解的高锰酸钾粉末较多 (3)反应生成的锰酸钾在较高温度下受热分解放出氧气(或反应生成的锰酸钾和二氧化锰在较高温度下受热分解放出氧气) 取一定量的二氧化锰置于试管中,加热一段时间后,冷却,称量剩余药品的质量,若质量减少,则小峰的假设成立,反之不成立(或取一定量的二氧化锰置于试管中,加热一段时间后,把带火星的木条伸入试管中,若木条复燃,说明小峰假设成立,反之不成立)
[解析] (2)高锰酸钾粉末受热易飞溅,斜卧型装置中,随气流被带到试管口附近或试管口的棉花上的高锰酸钾比直立型装置中的多,则这部分高锰酸钾不能分解产生氧气,所以斜卧型装置中收集到的气体总体积小于直立型装置。(3)因为反应中生成二氧化锰、锰酸钾和氧气,锰酸钾、二氧化锰中均含有氧元素,所以可能是锰酸钾或二氧化锰在较高温度下受热分解放出氧气,也可能是锰酸钾和二氧化锰在较高温度下受热分解放出氧气。