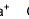一、物质的量的单位——摩尔
1、物质的量 是用来解决宏观物质和微观粒子之间关系问题的,表示含有一定数目粒子的集体的物理量。
a、是七个国际基本物理量之一
b、是一个专有名词,由固定字数组成,不能分割、不能增减。
c、符号为“n”
d、微粒是指:分子、原子、离子、中子等
e、粒子必须十分明确,且用化学式表示
摩尔
(1)概念:是物质的量的单位,简称摩。
(2)符号:mol
(3)基准:每摩尔物质中含有6.02×1023个微粒
阿伏加德罗常数(原意):以12g 12C中所含的原子数目为标准的,也就是说,如果在一定量的粒子集体中所含有的粒子数与12g 12C中所含的碳原子数目相同,则它的物质的量为1mol,而这个数值(粒子数)就叫阿伏加德罗常数
(4)数值:阿佛加德罗常数,用NA表示。
(5)规定:1mol任何粒子的粒子数叫做阿佛加德罗常数。
(6)近似值:6.02´1023
(7)物质的量、阿佛加德罗常数与粒子数(符号为N)之
间的关系:
使用摩尔时应注意:
摩尔是物质的量的单位,1摩尔任何物质含有阿佛加德罗常数(NA)个微粒。
(1)摩尔这一单位,通常用来表示原子、分子、离子、电子等特定对象。不能用来表示如1mol人等,摩尔定义中的每摩尔物质,通常指某种微粒。
(2)使用摩尔时,微粒的名称应予以指出,通常是将微粒的符号写在摩尔名称或符号的后面。
思考:
判断下列说法是否正确
(A)1 摩尔氧 错误,必须指明微粒的种类,是氧原子、氧分子还是氧离子
(B)1 摩尔氧原子 正确 1mol O
(C)2 摩尔分子氢 错误,2mol H2
(D)3 摩尔 水 正确 3mol H2O
(E)0.5 摩 二氧化碳 正确 0.5mol CO2
思考:已知:一个碳原子的质量为 1.993 × 10-23g 求: 12g 碳-12 中所含的碳原子数?
解:
思考:
1、1molH2O中多少mol的H,多少mol 的O?
1个水分子中有2个氢原子和1个氧原子,当同时扩大阿佛加德罗常数倍之后,有如下关系:
H2O——2H——O 即H2O——2H——O
1 2 1 1mol 2mol 1mol
NA 2 NA NA
2、1molC中约含有 个碳原子
3、0.3 mol H2SO4含有 个硫酸分子
4、1molNa2CO3中约含有_____molNa 、______molCO32-离子,共含有离子的个数为____________个。
课堂练习:
1、0.5molNa2SO4含有 molNa ; molSO42-;含 个O。
2、0.1molNH4 中含有 个N,含有 个H.
1mol物质的质量到底有多大?
粒子符号
物质的式量
每个粒子的质量(g/个)
1摩物质含有的粒子数
1摩物质质量(g)
C
12
1.993X10-23
NA
12
Fe
56
9.032X10-23
NA
56
H2SO4
98
1.628X10-23
NA
98
H2O
18
2.990X10-23
NA
18
Na
23
3.821X10-23
NA
23
OH-
17
2.824X10-23
NA
17
3、分析以上计算结果可得出什么规律?
(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2)1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3)1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。
结论:1mol任何微粒或物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
课堂练习:
(1)1molCu质量是 克 (2)1molO2质量是 克
(3) 1molCO2质量是 克 (4) 1molCl-质量是 克
(5) 1molNa 质量是 克 (6) 1molNaCl质量 克
二、摩尔质量
(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。
(2)符号:M (3)单位:g/mol (4)数值:等于物质或粒子的式量
(5)物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系:n(mol)=
注 意:
(6)物质的量、摩尔质量、物质的质量;阿伏加得罗常数、 6.02X1023之间的区别。
物质的量应用于化学方程式的计算
例:49g硫酸物质的量是多少?2mol硫酸的质量是多少?
例:实验室用20gCaCO3和200ml的盐酸恰好完全反应,计算:
生成CaCl2的物质的量
小结
1.计算的基本步骤(1)写出化学方程式。(2)写出已知、未知量(3)列出比例式求解x。
(4)写出答案。
2.弄清应注意的问题
(1)化学方程式所表示的是纯净物质之间的量的关系。
(2)单位问题:上下一致,左右相当。
(3)如果是离子反应,可以根据离子方程式进行计算。
如果是氧化还原反应,也可以利用电子转移关系进行有关计算。
三、气体摩尔体积:
① 定义:在一定的温度和压强下,单位物质的量的物质所占有的体积。表达式:Vm=V/n,
常用单位:L/mol。 标况下,气体的摩尔体积约为22.4L/mol。
② 使用标况下气体摩尔体积应注意:a、条件:标准状况;b、单位:L/mol;c、适用范围:气体;d、数值约为22.4L/mol
③ 应用气体摩尔体积(标况)计算的几种情况:
气体体积V 物质的量n 质量m 摩尔质量M 密度ρ 式量Mr
Ⅰ、据气体体积求其物质的量:n=V/22.4L/mol
Ⅱ、据气体质量求其标况下体积:V=m (22.4L/mol)/M
Ⅲ、据气体摩尔质量求其标况下密度:ρ=M/22.4L/mol
Ⅳ、据气体标况下的体积求质量:m= VM/22.4L/mol
Ⅴ、据标况下气体密度求式量:M=ρ22.4L/mol
④ 标准状况是指温度为0℃,压强为101KPa。
练 习
1、1 molH2O中约含有_________ 个H2O、_____________个H、__________个O、_____________mol H、______mol O、_____________mol e-
2、下列叙述正确的是( C )
A、1 mol 任何气体的体积都约为22.4L
B、1 mol任何物质在标准状况下所占的体积都约是22.4L
C、标准状况下,22.4L的任何气体的物质的量都是1 mol
D、标准状况下,1 mol水所占有的体积是22.4L
3、如果a g 某气体中含有的分子数为b ,则c g 该气体在标准状况下的体积是(式中NA为阿伏
加德罗常数) ( A ) A. 22.4bc/aNA L B. 22.4ab/cNA L
C. 22.4ac/bNA L D. 22.4b/acNA L
4、同温同压下某容器充满O2时重116g ,充满CO2时重122g,充满某气体时重114 g,则该气体的相对分子质量是( A ) A.28 B.60 C.32 D.44
解:设瓶重为m(瓶),则
{116 - m(瓶)}/32 = {122-m(瓶)}/44
m(瓶)=100g,
三种气体的物质的量均为: n =((116-100)g)/32g·mol-1) =0.5mol,
故 M(气体)= (144g-100g)/0.5mol =28g·mol-1.
四、物质的量浓度
含义:单位体积溶液里所含溶质B的物质的量,称为B的物质的量浓度。
符号 C(B) 单位 mol/L。
表达式:
物质的量浓度(mol/L)= CB=nB/V
气体溶于水时的浓度计算,要注意以下几个问题:
1、不能把水的体积当成溶液的体积; 2、不能把水的体积 气体体积当成溶液的体积;
3、用溶液质量和密度计算溶液体积时,要注意换算为L做单位。
五、一定物质的量浓度的溶液的配制
仪器:烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用)
步骤:以配置100mL1.00mol/L的氯化钠溶液为例
1、计算:NaCl的质量n(NaCl)=1.00mol/L×0.1L=0.1mol m(NaCl)=0.1mol×58.5g/mol=5.85克
2、称量:(复习天平的使用)
3、溶解:在烧杯中用30-50毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)
4、转移:将烧杯中的NaCl溶液注入100mL容量瓶(用玻璃棒引流)
5、洗涤:洗涤烧杯2~3次(每次用10mL左右的水)
6、定容:向容量瓶中加蒸馏水,加水到接近刻度线1~2厘米时,改用胶头滴管加水至液面与刻度线相切。
7、摇匀:反复摇匀
8、装瓶、贴标签 :装入试剂瓶并贴上标签
注意事项:
1)用胶头滴管定容后振荡,出现液面低于刻度线时不要再加水。
2)如果定容时超过了刻度线,不能将超出的部分吸走,要重新配置。
3)如果摇匀时不小心洒出几滴,不能直接加水至刻度线,要重新配制。
4)溶液注入容量瓶前要恢复到室温。
5)不能配制任意体积的一定物质的量浓度的溶液。
6)溶液转移时要洗涤烧杯、玻璃棒2-3次。
误差分析:
练习:
1、容量瓶上标有:①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式六项中的( A )
A ①③⑤ B ②④⑥ C ③⑤⑥ D ①②③
2、用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为:
100mL容量瓶 烧杯 量筒 玻璃棒 胶头滴管
3、配制200mL0.1mol/L的NaCl溶液,需NaCl的质量为多少克?
4、欲配制1mol/L的氢氧化钠溶液250mL,完成下列步骤:
① 用天平称取氢氧化钠固体___g。
② 将称好氢氧化钠固体放入___中加___蒸馏水将其溶解,待___后,将溶液沿___移入___mL的容量瓶中。
③ 用少量蒸馏水冲洗___次,将冲洗液移入___中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏___(低或高)。
④ 向容量瓶内加水至刻度线___时,改用___小心加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏___,应该___。
⑤ 最后盖好瓶盖___,将配好的溶液移入___中并贴好标签
5、计算1mol/L氯化钡溶液中各离子的浓度。
浓溶液配制稀溶液 溶液稀释前后,溶质的物质的量不变
c(浓溶液).V(浓溶液)=c(稀溶液).V(稀溶液) ( 注:体积单位不一定用升,相同则可)
,