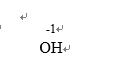氯元素的存在:Cl是一种重要的“成盐元素”,主要以化合态的形式存在,其种类很多。常见的有NaCl、KCl、MgCl2、CaCl2等,大量存在于海水、内陆的盐湖和盐矿中。
氯气的主要用途:单质氯气是一种重要的化工原料,用于制造盐酸、农药、有机溶剂、染料、药品等,也用于自来水的*菌消毒。
一、氯气的性质
瑞典化学家舍勒用软锰矿与浓盐酸加热,产生了一种黄绿色的、有刺激性气味的气体。

英国化学家戴维确认了这种黄绿色气体是氯元素的单质。
科学研究需要长时间的坚持不懈,科学知识的积累要经历多人的努力,科学研究要不断质疑,科学需要建立在严格的实验和观测的基础上。
物理性质:
通常是黄绿色的、有刺激性气味的气体,易液化成液氯,密度比空气大,能溶于水,一个体积水能溶解1-2个体积的氯气,其水溶液称氯水。
毒性:
氯气有剧毒,吸入少量会引起剧烈咳嗽和胸部疼痛,吸入大量氯气会中毒致死。第一次世界大战时曾作为化学武器使用,现在国际上禁止使用化学武器。
如果发生氯气的泄漏,可用肥皂水等碱性物质润湿的毛巾捂住口鼻,逆风往高处转移。并向空气中喷洒石灰等碱性物质,吸收氯气。
氯原子的结构:

氯原子的结构示意图
氯原子的最外层有7个电子,且原子半径较小,原子核对最外层电子的吸引力较大,很容易得到1个电子成为8e-的稳定结构。所以氯元素是一种典型的非金属元素,有很强的非金属性。
氯气(Cl2)分子的结构:
Cl2分子是由两个Cl原子构成的双原子分子,两个Cl原子各拿一个电子形成共用电子对,满足双方都成为8e-的稳定结构。
Cl—Cl
氯气是活泼的非金属单质,有强氧化性,在化学变化中作强氧化剂。
氯气与金属单质的反应:
氯气与绝大多数金属化合,生成金属氯化物(盐酸盐)。

铁、铜等金属与氯气反应生成高价的FeCl3和CuCl2,不会生成低价的FeCl2和CuCl,说明Cl2的氧化性比较强。
氯气与非金属单质的反应:
实验将纯净的H2点燃后(点燃前要验纯),伸入充满Cl2的集气瓶中。
纯净的H2在Cl2中安静的燃烧,发出苍白色的火焰,瓶口有白雾。