五、过滤

(一)、所需仪器和用品:
漏斗、烧杯、玻璃棒、铁架台(带铁圈)、滤纸
(二)注意事项
一贴:滤纸紧贴漏斗内壁
二低:滤纸边缘低于漏斗边缘、漏斗内液面低于滤纸边缘
三靠:烧杯紧靠引流玻璃棒的中下部、玻璃棒的末端要轻轻地斜靠在三层滤纸处、漏斗下端尖嘴紧靠烧杯内壁
(三)、过滤操作中的错误及后果
1、滤纸的相关操作错误
(1)漏斗和滤纸之间有气泡 有气泡部分的滤纸无法过滤,过滤速度减慢。
(2)液面高于滤纸边缘 液体从滤纸与漏斗的间隙流下,滤液浑浊
2、玻璃棒的相关操作错误
(1)玻璃棒贴着单层滤纸一边容易捅破滤纸,导致滤液浑浊
(2)没有用玻璃棒引流容易将溶液滴到漏斗外面,进入承接的烧杯中,使滤液浑浊。
(3)过滤时为了加快过滤速度,用玻璃棒在漏斗中搅拌加速过滤捅破滤纸,使滤液浑浊。
3、其他操作影响:
(1)漏斗下沿没有紧贴烧杯内壁使滤液溅出,损失滤液
(2)仪器不干净滤液仍然浑浊。
(3)滤渣堵塞滤纸空隙过滤速度减慢。
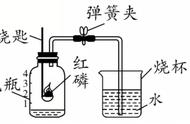
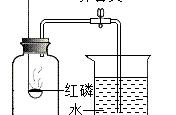
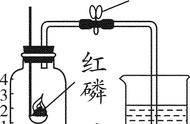
六、空气中氧气含量的测定

(一)、实验结论
1、氧气约占空气体积的五分之一,可支持燃烧。
2、其余气体约占空气体积的五分之四,无色无味,难溶于水,不可燃也不支持燃烧
3、空气是混合物。
(二)、实验关键点
1、足量红磷,用于完全消耗氧气
2、气密性良好
3、冷却到室温后打开止水夹,防止温度对气体体积测量产生影响。
4、点燃红磷后,需迅速插入集气瓶中
(三)误差分析:
测量氧气体积小于1/5,可能的原因有:
1、红磷的量不足,瓶内氧气没有耗尽,进入集气瓶中水的体积偏小,测量空气中氧气含量偏少;
2、装置漏气(如塞子未塞紧、燃烧匙与橡皮塞之间有缝隙等),使外界空气进入瓶内,体积差变小,进入集气瓶中水的体积偏小,测量空气中氧气含量偏少
3、未冷却至室温就打开弹簧夹,气体此时受热膨胀,体积差偏小,使进入瓶内的水的体积偏小,测量得到的空气中氧气含量偏小
测量空气中氧气含量大于1/5原因可能是:
1、点燃红磷后,插入燃烧匙时,瓶塞塞得太慢,使得瓶中空气受热膨胀,部分空气逸出,有气体损失,最终冷却到室温后,进入到集气瓶内的水偏多,测得空气中氧气含量偏大
2、实验开始时,没有夹或没夹紧止水夹,反应过程中部分空气从右侧导管口逸出,有气体损失,最终冷却到室温后,进入到集气瓶内水较多。测量空气中氧气含量偏大。
七、还原氧化铜
碳还原氧化铜

(一)、反应现象:
1、导管口有气泡冒出,澄清石灰水变浑浊
2、试管底部黑色固体变红
(二)、注意事项:
1、试管口略向下倾斜,防止冷凝水回流使试管底部炸裂
2、酒精灯火焰上罩一个铜网罩,(或者用酒精喷灯)可以集中火焰,提升温度。
3、实验结束时应该先将导管从盛有澄清石灰水的试管中撤离,再熄灭酒精灯,防止水倒流引起试管炸裂。
4、反应完毕后需在导管口加橡皮管,并用止水夹夹住,防止产生的铜与空气接触后被氧化,待试管完全冷却后,再倒出固体,观察反应产物。
一氧化碳还原氧化铜

(一)、反应现象:
1、黑色的固体变红色
2、澄清石灰水变浑浊
3、导管口气体燃烧,火焰为蓝色
(二)、注意事项:
1、先通一段时间一氧化碳,待右边导气管收集到的一氧化碳验纯后,再点燃酒精灯。排尽装置内空气,防止CO发生爆炸。
2、停止加热后要通一氧化碳至固体冷却至室温为止,防止红热的铜与空气接触再被氧化。
3、一氧化碳尾气有毒,要点燃或收集处理,防止未反应的一氧化碳污染空气
总结:气体“早出晚归”,酒精灯“迟到早退”。
重点:一氧化碳还原氧化铜的反应原理,反应现象
氢气还原氧化铜

(一)、反应现象:
1、黑色的固体变红色
2、试管口出现水珠(白色固体变蓝色晶体)
四、注意事项:
1、装置A试管口略向下倾斜,防止生成的水倒流,炸裂试管底部并有利于排空气。(装置B是硬质玻璃管,耐热温度更高且有氢气持续通入。)
2、氢气通入前要验纯,先通一段时间氢气,再点燃酒精灯。排尽空气,防止氢气发生爆炸。
3、停止加热后要再通一段时间氢气,直至铜完全冷却后停止通气,防止红热的铜与空气接触,再被氧化。
4、装置A中通氢气的导管要插到试管底部且靠上层,一方面将试管里的空气排尽(氢气密度小于空气,向下排空气),另一方面保证氢气与氧化铜充分接触。
总结:气体“早出晚归”,酒精灯“迟到早退”
**还原氧化铁除了颜色现象是由红色变成黑色,酒精灯变成酒精喷灯之外,注意的点都是与还原氧化铜是一样的
未完,明天继续……