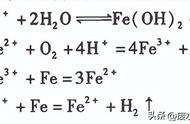一、常见的酸
(1)浓盐酸、浓硫酸的物理性质、特性、用途:
浓盐酸 | 浓硫酸 | |
颜色、状态 | 无色液体 工业用盐酸: 黄色(因为含Fe3 ) | 无色粘稠、油状液体,98%的浓硫酸的密度是1.84g/cm3 |
气味 | 有刺激性气味 | 无 |
特性 | 挥发性(挥发出氯化氢气体) (敞口置于空气中,则瓶口有白雾生成) | 吸水性 、脱水性、腐蚀性 |
用途 | ①金属除锈 ②制造药物 ③人体胃中含有少量盐酸,助消化 | ①金属除锈 ②浓硫酸作干燥剂、脱水剂 ③生产化肥、精炼石油 |
注意:
①浓盐酸密封保存的原因:浓盐酸具有挥发性,易挥发出氯化氢气体。
②浓硫酸密封保存的原因:浓硫酸具有吸水性,易吸收空气中的水蒸汽(相当于稀释)。
③浓盐酸敞口放置在空气中一段时间后,溶质、溶液质量减少,溶剂质量不变,所以溶质质量分数减小。
④浓硫酸敞口放置在空气中一段时间后,溶质质量不变,溶剂、溶液质量增加,所以溶质质量分数减小。
⑤稀释浓硫酸时:应把浓硫酸沿烧杯壁慢慢注入水里,并不断搅动。切不可把水直接倒入浓硫酸中。用玻璃棒搅拌的作用:①加速溶解 ②散热。
由于浓硫酸有强烈的腐蚀性,溶于水时又放出大量热,易使水沸腾而引起浓硫酸飞溅至皮肤和衣物上导致严重的后果,所以使用和稀释浓硫酸必须严格按要求进行: 稀释浓硫酸时,必须将浓硫酸缓缓地沿器壁注入水中、乙醇中、硝酸中,同时要搅动液体,以使热量及时地扩散。

⑥如果不慎将浓硫酸沾到皮肤或衣服上,应先用布拭去,再用水冲洗,最后涂上3%—5%的碳酸氢钠溶液。
2.浓硫酸具有以下特性:
吸水性:浓硫酸能吸收空气中的水分,可用来做干燥剂。碱性气体不宜用浓硫酸干燥,如氨气。
脱水性:浓硫酸能将纸张、木材、布料、皮肤里的氢、氧元素按水的组成比脱去,生成黑色的炭。
强氧化性(腐蚀性):活泼金属与浓硫酸在一定条件下发生反应时,没有氢气生成。
3.酸的化学性质(具有相似性质的原因:酸离解时所生成的阳离子全部是H ):
①与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色。
②金属 酸 == 盐 氢气 置换反应(条件:活动性:金属>H )
H2SO4 Fe == FeSO4 H2↑ 2HCl Fe == FeCl2 H2↑
③金属氧化物 酸== 盐 水
Fe2O3 6HCl == 2FeCl3 3H2O(注FeCl3溶液:黄色)现象:铁锈溶解,溶液由无色变为黄色。
CuO 2HCl== CuCl2 2H2O (注CuCl2溶液:蓝色)现象:黑色固体溶解,溶液由无色变为蓝色。
④碱 酸 == 盐 水
HCl NaOH == NaCl H2O H2SO4 2NaOH == Na2SO4 2H2O
⑤盐 酸 → 另一种盐 另一种酸(产物符合复分解条件)
注:a、复分解反应的条件:当两种化合物互相交换成分,生成物中有沉
淀或有气体或有水生成时,复分解反应才可以发生
b、常见沉淀:AgCl↓ BaSO4↓ Cu(OH)2↓ Fe(OH)3↓ Mg(OH)2↓ BaCO3↓ CaCO3↓
,