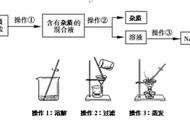
第20题图1
①分离得到溶液C的操作名称是________。
②写出步骤Ⅱ中反应的化学方程式______________________。
③上述步骤________(选填步骤编号)所包含的反应体现了铁的活动性比铜强。
实验二

第20题图2
④写出步骤Ⅳ中反应的化学方程式________________________。
⑤D、E是同一种溶质形成的溶液,请写出该溶质的名称、判断能否得出D、E溶液中该溶质质量的大小关系并说明理由:____________________________________________________________________________。
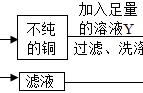
21.(2016内江)为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾(CuSO4·5H2O)。某课外活动小组的同学按如下流程进行实验。(反应中部分生成物已略去)

第21
题图
已知:Cu+2H2SO4(浓)eq \o(=====,\s\up7(△))CuSO4+SO2↑+2H2O。
回答下列有关问题:
(1)操作a的名称是__________;除去铜粉中的铁粉,最简便的实验方法是________________。
(2)FeCl2溶液中通入Cl2发生化合反应,写出该反应的化学方程式_______________________________。
(3)由Cu制CuSO4溶液的途径Ⅱ中,若不通入O2,反应将不会发生,原因是__________________________________________。途径Ⅱ与途径Ⅰ相比较,其显著的优点是____________________________(回答一点即可)。
(4)FeCl3溶液可腐蚀铜以制作印刷线路板,反应只生成两种常见的盐,则该反应的化学方程式为__________________________
____________。
类型6 水的净化
22.(2016桂林)河水含泥沙、细菌等杂质,需要净化处理成自来水。某市自来水厂的生产过程如图所示。

第22题图
(1)为了使沉淀池的悬浮物沉降,通常可加入________。
(2)沙滤池可将________________过滤除去。
(3)活性炭常用于吸附池中,原因是它具有____________的结构。
(4)常用于*菌池消毒的物质有多种,请写出其中一种物质的化学式________。
(5)要鉴别自来水是软水还是硬水,可向自来水样品中加入适量的________,搅拌,如果观察到____________,则样品为软水。
题型五 流程图
1. (1)搅拌,加速溶解
(2)Na2SO4
(3)CaCl2和BaCl2 [来源:学科网]
(4)否
2. (1)CaO+H2O=== Ca(OH)2 Ca(OH)2+MgCl2=== Mg(OH)2↓+CaCl2
(2)H2 盐酸
(3)CaCl2
3. (1)红
(2)
蒸发结晶
(3)吸收更多的二氧化碳
(4)做发酵粉(或治疗胃酸过多,合理即可)
(5)2NaHCO3eq \o(=====,\s\up7(△)) Na2CO3+H2O+CO2↑ 分解
4. (1)烧杯(或玻璃棒、漏斗等合理即可) 增大
(2)二氧化锰(或MnO2)
(3)4KOH+2MnO2+O2eq \o(=====,\s\up7(高温)) 2K2MnO4+2H2O
5. (1)Zn+2HCl=== ZnCl2+H2↑
(2)复分解反应
(3)过滤 滤纸破损(合理即可)
(4)CO2 CO
6. (1)+1
(2)大
(3)研磨
(4) 2Cu2O+Ceq \o(=====,\s\up7(800 ℃)) 4Cu+CO2↑ ①
(5)CO 作燃料(合理即可)
(6)表面变黑的是黄铜,不变色的是黄金
7. (1)+4
(2)FeCl3
(3)化合反应
(4)作保护气 2Mg+TiCl4eq \o(=====,\s\up7(800 ℃)) Ti+2MgCl2
8. (1)Al2O3+3H2SO4=== Al2(SO4)3+3H2O
(2)过滤
(3)作氮肥
(4)O2 C
9. (1)Fe2O3 + 6HCl=== 2FeCl3 + 3H2O(或CuO +
2HCl === CuCl2 + H2O或MgO + 2HCl === MgCl2 + H2O)
(2)Cu2+、Fe3+、Mg2+、H+ (3)6.7~9.1 (4)过滤
(5)MgCl2 +Ca(OH)2=== Mg(OH)2↓+CaCl2
10. (1)化合反应
(2) 2NaOH+ZnS2O4=== Na2S2O4+Zn(OH)2↓
(3)过滤
(4)Na2S2O4在碱性溶液中稳定 降低Na2S2O4在水中的溶解度
(5)130
11. (1)氢氧化钠和碳酸钠
(2)+4
(3)2NaClO3+SO2=== Na2SO4+2ClO2
(4)温度过高,高氯酸钠易分解;温度过低,干燥不充分(或75 ℃~95 ℃,干燥充分且高氯酸钠晶体不易分解)
12. (1)2 3O2 2 2
(2)使各反应物充分接触、加快反应速率
(3)C、Fe、Zn
(4)电解槽、底吹炉
13. (1)Zn和Cu(或锌和铜) 漏斗
(2)Zn+H2SO4=== ZnSO4+H2↑
(3)不断搅拌,防止因局部温度过高,造成液滴飞溅
14. (1)过滤
(2)将废铁屑中铁完全反应
(3)4FeCO3+O2eq \o(=====,\s\up7(高温)) 2Fe2O3+4CO2
15. (1)1∶1 (2)2H2SO3+O2=== 2H2SO4 (3)B
16. (1)CuSO4
(2)BaCl2+Na2CO3=== BaCO3↓+2NaCl
(3)Na2CO3、KOH KCl 取少量无色溶液A于试管中,加入足量的稀硝酸,然后滴加硝酸银溶液,产生白色沉淀,则固体中一定含有KCl,否则不含KCl
17. (1)漏斗 引流
(2)CaCO3、Mg(OH)2 NaOH、BaCl2 BaCO3
(3)MgCl2
18.(1)K+、H+
(2)2Fe(OH)3+3H2SO4=== Fe2(SO4)3+6H2O
(3)2Cu+O2eq \o(=====,\s\up7(△)) 2CuO
(4)K2CO3、Fe(OH)3和Cu
19. (1)过滤
(2)NaOH+HCl=== NaCl+H2O(或Na2CO3+2HCl=== 2NaCl+CO2↑+H2O)
(3)使液体受热
均匀(或防止液体外溅)
(4)CE
20. ① 过滤
② Fe + H2SO4 === FeSO4 + H2↑、
Fe + CuSO4 === FeSO4 + Cu
③ Ⅱ、Ⅲ
④H2+CuO eq \o(=====,\s\up7(△)) Cu + H2O
⑤硫酸亚铁,D中FeSO4是步骤Ⅱ中多余的铁与稀硫酸反应所得,E中FeSO4是原混合物中铁与稀硫酸反应所得,二者的大小关系不能确定
21. (1)过滤 用磁铁吸引
(2)2FeCl2+Cl2=== 2FeCl3
(3)铜在金属活动性顺序表中排在氢的后面,不能和硫酸发生置换反应 不产生污染物SO2
(4)2FeCl3+Cu=== 2FeCl2+CuCl2
22. (1)明矾
(2)泥沙
(3)疏松多孔
(4)ClO2(或Cl2)
(5)肥皂水 泡沫丰富
,