元素推断题的一般思维模板:根据原子结构、元素周期表的知识及已知条件,可推算原子序数,判断元素在周期表中的位置等,基本思路如下:

类型1 元素在周期表中的位置推断
1.根据核外电子的排布规律
(1)最外层电子数规律

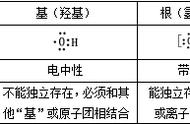
(2)"阴三、阳四"规律:某元素阴离子最外层电子数与次外层相同,该元素位于第三周期;若为阳离子,则位于第四周期。
(3)"阴上、阳下"规律:电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
2.根据元素周期表结构与原子电子层结构的关系推断
(1)核外电子层数=周期序数;
(2)主族序数=最外层电子数=最高正价=8-|最低负价|(氧、氟元素除外);
(3)|最高正价|-|最低负价|=eq \b\lc\{\rc\ (\a\vs4\al\co1(0——ⅠA族中, 的H和ⅣA族,2——ⅤA族,4——ⅥA族,6——ⅦA族))
3.周期表中特殊位置的元素(1~20号元素)
(1)族序数等于周期数的元素:H、Be、Al。
(2)族序数等于周期数2倍的元素:C、S。
(3)族序数等于周期数3倍的元素:O。
(4)周期数是族序数2倍的元素:Li、Ca。
(5)周期数是族序数3倍的元素:Na。
(6)最高正价与最低负价代数和为零的短周期元素:H、C、Si。
(7)最高正价是最低负价绝对值3倍的短周期元素:S。
(8)除氢外,原子半径最小的元素:F。
[对点训练]
1.主族元素M、R形成的简单离子M2-与R+的核外电子数之和为20,下列说法正确的是( )
A.M原子的质子数一定大于R原子的质子数
B.M可能存在16M、18M两种核素
C.M2-与R+的电子层结构不可能相同
D.两种离子结合形成的化合物中不含有共价键
B [根据主族元素M、R形成的简单离子M2-与R+的核外电子数之和为20,可知M、R可能为O元素和Na元素或S元素和Li元素。O元素的质子数小于Na元素的质子数,A错误;O元素存在18O和16O两种核素,B正确;O2-和Na+的电子层结构相同,C错误;两种离子结合形成的化合物可能为Na2O2,既含离子键又含共价键,D错误。]
2.已知X、Y、Z为三种短周期主族元素,可分别形成Xn+、Ym+、Zn-三种离子,已知m>n且X、Y、Z三种原子的M层电子数均为奇数。下列说法中不正确的是( )
A.三种离子中,Ym+的离子半径最小
B.Z的最高价氧化物对应水化物的分子式为HZO4
C.X、Y、Z一定在同一周期,且原子半径Z>X>Y
D.三种元素相应的最高价氧化物对应水化物之间两两会发生反应
C [根据题中X、Y、Z之间的相互关系,可以推断出X、Y、Z分别为Na、Al、Cl元素。Na+、Al3+、Cl-三种离子中Al3+的离子半径最小,A项正确;Cl的最高价氧化物对应水化物的化学式为HClO4,B项正确;Na、Al、Cl元素同处于第三周期,其原子半径为Na>Al>Cl,即X>Y>Z,C项错误;氢氧化铝为两性氢氧化物,D项正确。]
3.X、Y、Z是三种主族元素,如果Xn+阳离子与Yn-阴离子具有相同的电子层结构,Zn-阴离子半径大于Yn-阴离子半径,则三种元素的原子序数由大到小的顺序是( )
A.Z>X>Y B.X>Y>Z
C.Z>Y>X D.X>Z>Y
A [根据"序、层"规律可知,X元素在Y元素的下一周期,Z元素在X同周期或下几个周期,故三种元素的原子序数大小顺序为Z>X>Y。]
类型2 根据物质的组成和特性进行推断
1.物质的特殊组成
(1)O与H可形成H2O和H2O2。
(2)O与Na可形成Na2O和Na2O2。
(3)C与H可形成多组成的烃类物质(如CH4、C2H4、C2H2等)。
(4)N与H可形成NH3、N2H4、NH4H。
(5)O与S可形成SO2、SO3。
(6)N的含氧酸有HNO2、HNO3。
(7)S的含氧酸有H2SO4、H2SO3。
(8)Cl的含氧酸有HClO、HClO2、HClO3、HClO4。
(9)Si的含氧酸有H2SiO3、H4SiO4。
(10)N与O可形成N2O、NO、N2O3、NO2、N2O4、N2O5。
2.物质的特性
(1)形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C。
(2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3)地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:O。
(4)单质最轻的元素:H;最轻的金属单质:Li。
(5)单质在常温下呈液态的非金属元素:Br;金属元素:Hg。
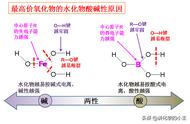
(6)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
(7)元素的气态氢化物和它的最高价氧化物的水化物能起化合反应的元素:N;能起氧化还原反应的元素:S。
(8)元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
(9)最活泼的非金属元素(或无正价的元素、无含氧酸的非金属元素、其无氧酸可腐蚀玻璃的元素、其气态氢化物最稳定的元素或阴离子的还原性最弱的元素):F。
(10)自然界最活泼的金属元素(或最高价氧化物的水化物碱性最强的元素、阳离子氧化性最弱的元素):Cs。
(11)最高价氧化物对应水化物酸性最强的元素:Cl。
(12)最高价氧化物的水化物与最低价氢化物能反应生成盐的元素:N。
[对点训练]
4.原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成共价化合物XH3、H2Z和HW;Y与氧元素可组成离子化合物Y2O和Y2O2。
(1)写出Y2O2的化学式________,其中含有的化学键是________。
(2)X、Z、W三种元素的最高价氧化物对应的水化物酸性最强的是(填写化学式):________。
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是(填写化学式):____________,生成物属于________化合物(填"离子"或"共价")。
(4)写出下列物质的电子式
①XW3:________,②Y2Z:________。
(5)X的气态氢化物的结构式:____________。
[解析] 由共价化合物XH3、H2Z和HW知,X、Z、W分别在ⅤA族、ⅥA族和ⅦA族,由原子序数X<Y<Z<W和离子化合物Y2O、Y2O2推知X、Y、Z、W分别为N、Na、S、Cl。
(1)Na2O2中含有离子键和非极性共价键。
(2)HNO3、H2SO4、HClO4中酸性最强的是HClO4。
(3)NH3是碱性气体,H2S、HCl均为酸性气体,因此NH3可与H2S、HCl都反应生成相应的铵盐,铵盐中含离子键和共价键,属于离子化合物。

[答案] (1)Na2O2 离子键、非极性共价键
(2)HClO4 (3)NH3 离子

5.已知短周期主族元素X、Y、Z、W、Q的原子序数逐渐增大,其中X和Z、Y和W分别为同主族元素,X元素的原子内层电子数是最外层电子数的一半,W的最高价氧化物对应的水化物是二元强酸,则下列说法中正确的是( )
A.五种元素均能形成不同种同素异形体
B.X和Y、W分别可以形成XY2、XW2型化合物
C.氢化物稳定性由强到弱的顺序是:Q、W、Z、X
D.W形成的简单阴离子半径小于Q形成的简单阴离子半径
B [X、Y、Z、W、Q为原子序数逐渐增大的短周期主族元素,且X元素的原子内层电子数是最外层电子数的一半,则X为C;X和Z为同主族元素,则Z为Si;W的最高价氧化物对应的水化物是二元强酸,则W为S;根据短周期主族元素X、Y、Z、W、Q的原子序数逐渐增大,Y和W为同主族元素,可知Q为Cl、Y为O。A项,Cl元素不能形成不同种同素异形体,错误;B项,C和O、S可以形成CO2、CS2,正确;C项,根据元素周期律,氢化物稳定性:X>Z,错误;D项,W形成的简单阴离子为S2-,Q形成的简单阴离子为Cl-,离子半径:S2->Cl-,错误。]
6.(2017·南通模拟)已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价与W元素最高正价绝对值相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水。下列说法正确的是( )
A.简单离子半径:Y>Z>W
B.简单氢化物的热稳定性:X>Y>R
C.W的最高价氧化物对应的水化物碱性比Z的强
D.R的最高价氧化物对应的水化物化学式一定是HRO4
A [由题意推知,X为N,Z为Na,W为Al,Y若为F,则R为Cl,Y若为O,则R为S。A项,离子半径:F-(或O2-)>Na+>Al3+,正确;B项,Y的非金属性最强,形成的气态氢化物最稳定,错误;C项,金属性:Na>Al,碱性:NaOH>Al(OH)3,错误;D项,R可形成H2SO4或HClO4,错误。]
类型3 根据"位—构—性"进行综合推断
1.元素周期表的特殊结构
(1)元素周期表中第一周期只有两种元素H和He,H元素所在的ⅠA族为元素周期表的左侧边界,ⅠA族左侧无元素分布;
(2)He为0族元素,0族元素为元素周期表的右侧边界,0族元素右侧没有元素分布。
(3)三个短周期,第一周期为2种元素,第二、三周期有8种元素。
2.一般分析思路
题中文字信息→推断出元素→图表中固定位置eq \o(――→,\s\up15(转化))周期表片段→应用
[对点训练]
7.(2017·咸阳模拟)有X、Y、Z、W、M五种原子序数依次增大的前四周期元素,其中X、M同主族,M原子有4个电子层;Z2+与Y2-具有相同的电子层结构,W是地壳中含量最多的金属,X与M的原子序数之和等于Y与Z的原子序数之和。下列叙述不正确的是( )
A.离子半径大小:r(Y2-)>r(Z2+)
B.W的氧化物可与M的最高价氧化物的水化物反应
C.X有多种同素异形体,而Y不存在同素异形体
D.X、Y的单质均能与M形成离子化合物
C [根据题中信息可确定X、Y、Z、W和M分别为H、O、Mg、Al和K。A项,电子层结构相同的离子,核电荷数越小离子半径越大;B项,Al2O3能与KOH溶液反应;C项,氢元素有多种同位素,氧元素存在同素异形体;D项,存在KH、K2O等离子化合物。]
8.(2017·东北三省四市一模)X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是( )
A.原子半径:Z>R>W
B.X2W6分子中各原子满足8电子结构
C.气态氢化物沸点:HmY>HnR
D.Y、Z、R三种元素组成的化合物水溶液一定显碱性
D [离子化合物Z2Y中Z的化合价为+1价,Y的化合价为-2价,分别为ⅠA族和ⅥA族元素,已知Y、R同主族,且形成共价化合物RY3,则R为S元素,Y为O元素,Z、R、W同周期,则Z为Na元素,X、Y、Z、R、W是5种短周期元素,原子序数依次增大,则W是Cl元素,根据XW4可知X为C元素。]
9.A、B、C、D、E、F六种短周期元素,其原子序数依次增大。A原子的最外层电子数是次外层电子数的2倍,C的氢化物在常温下为液体,D能形成DF型离子化合物,0.9 g E 与足量的稀硫酸反应生成的氢气在标准状况下的体积为1.12 L,F的族序数与周期序数之差为4。请回答下列问题:
(1)写出元素符号:A________;B________;C________;D________;E________;F________。
(2)六种元素中,单质还原性最强的是________(写化学式,下同);最高价氧化物对应水化物中酸性最强的是________。
(3)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因:_______________。
(4)D、E元素的最高价氧化物对应的水化物发生反应的离子方程式为_______。
[解析] (1)根据题意可知A为C,B为N,C为O,D为Na,E为Al,F为Cl。(2)六种元素中单质还原性最强的为Na,Cl的非金属性最强,其最高价氧化物对应水化物HClO4的酸性最强。(3)NaClO是家用消毒剂,由于ClO-的水解使溶液呈碱性。(4)NaOH溶液和Al(OH)3发生反应的离子方程式为Al(OH)3+OH-===AlOeq \o\al(-,2)+2H2O。
[答案] (1)C N O Na Al Cl
(2)Na HClO4
(3)ClO-+H2OHClO+OH-
(4)Al(OH)3+OH-===AlOeq \o\al(-,2)+2H2O
10.(2016·海南高考)短周期元素X、Y、Z、M的原子序数依次增大。元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第________周期、________族。
(2)Z元素是________,其在自然界中常见的二元化合物是________。
(3)X与M的单质在高温下反应的化学方程式为___________________,
产物分子为直线形,其化学键属________(填"极性"或"非极性")共价键。
(4)四种元素中的________可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为_________________________________。
[解析] 根据提供信息,可以推断出X为C,Y为Mg,Z为Si,M为S。(1)硫元素位于元素周期表第三周期、ⅥA族。(2)Z为Si,其在自然界中常见的二元化合物为SiO2。(3)C与S在高温下反应生成CS2,其结构式为S===C===S,所含化学键为极性共价键。(4)四种元素中Mg可用于航空航天合金材料的制备,Mg与稀盐酸反应的化学方程式为Mg+2HCl===MgCl2+H2↑。
[答案] (1)三 ⅥA (2)Si SiO2 (3)C+2Seq \o(=====,\s\up15(高温))CS2 极性
(4)Mg Mg+2HCl===MgCl2+H2↑
,