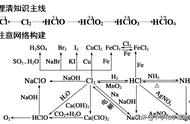
一、元素周期律与元素周期表(体现着量变质变规律)
(三)元素的金属性与非金属性强弱判断的方法:
1.元素的金属性强弱推断的方法:
元素的金属性 | 其单质从水或酸中置换出氢 | 其最高价氧化物的水化物的碱性 |
强 | 容易 | 强 |
2.元素的非金属性强弱推断的方法
元素的非金属性 | 其单质与氢气反应形成气态氢化物 | 气态氢化物的稳定性 | 其最高价氧化物的水化物的酸性 |
强 | 容易 | 稳定 | 强 |
3.金属性、非金属性不列入物质的化学性质或物理性质的原因:
从以上元素的金属性、非金属性强弱推断的方法可知,元素的金属性、非金属性已经超脱具体物质的化学性质或物理性质。具体物质的化学性质是通过该物质发生化学反应体现的性质,物理性质是不需要通过化学反应体现的性质,包括具体物质本身固有的性质,如颜色、气味、某条件下的状态、密度,和通过物理变化体现的性质,如溶解性、熔沸点、硬度、导电性、传热性、延展性、金属光泽。而元素的金属性不但通过金属单质从水或酸中置换出氢的反应去推断,也即去显示,而且通过元素的化合物——最高价氧化物的水化物的碱性去推断,即通过化学性质去体现;元素的非金属性不但通过非金属单质与氢气形成气态氢化物的反应去推断,而且通过元素的化合物——气态氢化物的稳定性和最高价氧化物的水化物的酸性去推断,稳定性、酸性、碱性都属于化学性质。也就是说,元素的金属性、非金属性既通过化学反应体现,又通过化学性质体现。不仅如此,元素的金属性还通过单质的物理性质体现。如,判断硅元素具有金属性,就是根据硅单质具有弱导电性。
4.推出元素主要化合价的方法:
(1)主族元素的最高正价=原子最外层电子数=主族序数;
(2)非金属的最低负价=原子最外层电子数-8。除氢元素的最第负价=1-2=-1外。
5.元素的金属性的定义及其强弱判断的方法
(1)金属性的定义:金属元素的性质。包括金属单质的物理共性(能导电、能传热、能延展、有金属光泽)和化学共性(还原性)、金属离子的氧化性、化合物中金属元素的化合价、最高价氧化物的水化物的碱性。
因为《辞海》中定义金属性为“元素的原子失去电子的能力”,这是还原性的定义,两个不同概念的定义不能相同。否则会导致金属性与还原性两个概念混淆。金属元素本就包括金属单质及其化合物。所以,如上定义金属性。
(2)元素金属性强弱判断方法:
①由元素周期表或原子结构进行判断,同周期从左到右金属性逐渐减弱,同主族从上到下金属性逐渐增强。或原子的电子层数相同时,原子最外层电子数增加,元素的金属性减弱;原子最外层电子数相同时,原子的电子层数增加,元素的金属性增强。
②用元素的电负性、最高价氧化物的水化物的电离常数判断,特别适用于判断不同周期、不同主族元素的金属性强弱,元素的电负性越小或相同温度时,最高价氧化物的水化物的电离常数越大,元素的金属性越强。
③由二元化合物的化合价判断,两种元素组成的化合物,呈正价元素的金属性较强(呈负价元素的非金属性较强)。
④由单质与同一氧化剂反应的难易程度判断,反应越容易,元素的金属性越强。此已经包含由单质与水(或酸)反应置换出氢的难易程度判断,单质与水(或酸)置换出氢越容易,元素的金属性越强。
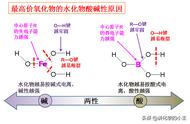
⑤由最高价氧化物的水化物(氢氧化物)的碱性强弱来判断,最高价氢氧化物碱性越强,元素的金属性越强。
⑥由金属活动性顺序表进行判断,按金属活动性顺序,金属元素的金属性依次减弱。
⑦由单质的还原性判断,或单质的还原性越强,则对应元素的金属性越强。
⑧由单质与化合物之间的置换反应判断,遵循强制弱的规律。
⑨由金属阳离子的氧化性强弱判断,一般情况下,金属阳离子的氧化性越弱,对应元素的金属性越强。特例:三价铁的氧化性强于二价铜,但铁的金属性强于铜。
⑩由原电池的正负极判断,一般情况下,活泼性强金属电极做负极。
6.元素的非金属性的定义及其强弱判断的方法
(1)非金属性的定义:非金属元素的性质。包括非金属单质的物理共性(不能导电、不能传热、不能延展、没有金属光泽)和化学共性(主要是氧化性)、化合物中非金属元素的化合价、最低价氢化物稳定性、最高价氧化物的水化物的酸性。其道理与金属性定义相似。
(2)元素非金属性强弱判断方法:
①由元素周期表或原子结构进行判断,同周期从左到右非金属性逐渐增强,同主族从上到下非金属性逐渐减弱。或原子的电子层数相同时,原子最外层电子数增加,元素的非金属性增强;原子最外层电子数相同时,原子的电子层数增加,元素的负金属性减弱。
②用元素的电负性、最高价氧化物的水化物的电离常数判断,特别适用于判断不同周期、不同主族元素的非金属性强弱,元素的电负性越大或相同温度时,最高价氧化物的水化物的电离常数越大,元素的非金属性越强。
③由二元化合物的化合价判断,两种元素组成的化合物,呈负价元素的非金属性较强(呈正价元素的金属性较强)。
④由单质与同一还原剂反应的难易程度判断,反应越容易,元素的非金属性越强。此已经包含由单质与氢气化合生成气态氢化物的难易程度判断,单质与氢气化合生成气态氢化物越容易,元素的非金属性越强。
⑤由气态氢化物越稳定性判断,气态氢化物越稳定,元素的非金属性越强。
⑥由最高价氧化物的水化物的酸性强弱来判断,元素最高价氧化物的水化物的酸性越强,元素的非金属性越强。
⑦由单质的氧化性判断,或单质的氧化性越强,则对应元素的非金属性越强。
⑧由单质与化合物之间的置换反应判断,遵循强制弱的规律。注意:此处非金属单质作氧化剂。
⑨由非金属阴离子的还原性强弱判断,一般情况下,非金属阴离子的还原性越弱,对应元素的非金属性越强。
,