元素周期表是高中化学学习的重要工具和载体之一,对元素周期表相关规律的考查也是高考命题的重要方向之一。本文总结了元素周期表中蕴含的主要规律。
一、最外层电子数规律
1.最外层电子数为1的元素:主族(IA族)、副族(IB、VIII族部分等)。
2.最外层电子数为2的元素:主族(IIA族)、副族(IIB、IIIB、IVB、VIIB族)、0族(He)、VIII族(26Fe、27Co等)。
3.最外层电子数在3~7之间的元素一定是主族元素。
4.最外层电子数为8的元素:0族(He除外)。
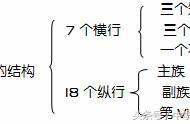
二、数目规律
1.元素种类最多的是第IIIB族(32种)。
2.同周期第IIA族与第IIIA族元素的原子序数之差有以下三种情况:
(1)第2、3周期(短周期)相差1;
(2)第4、5周期相差11;
(3)第6、7周期相差25。
3.设n为周期序数,每一周期排布元素的数目为:奇数周期为;偶数周期为。如第3周期为种,第4周期为种。
4.同主族相邻元素的原子序数:
第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数 上一周期元素的数目;
第IIIA~VIIA族,下一周期元素的原子序数=上一周期元素的原子序数 下一周期元素的数目。
三、化合价规律
1.同周期元素主要化合价:最高正价由 1→ 7(稀有气体为0价)递变、最低负价由-4→-1递变。
2.关系式:
(1)最高正化合价 |最低负化合价|=8;
(2)最高正化合价=主族族序数=最外层电子数=主族价电子数。
3.除第VIII族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。
四、对角线规律
金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。
五、分界线规律
位于金属与非金属之间的分界线,右上方的元素为非金属(周期表中的颜色为深绿色),在此可以找到制造农药的元素(如Cl、P等),左下角为金属元素(H除外),分界线两边的元素一般既有金属性,又有非金属性;能与酸和碱反应(如Be、Al等),还可找到制造半导体材料的元素(如Si、Ge等)。
六、金属性、非金属性变化规律
1.同一周期,从左到右(0族除外)金属性减弱,非金属性增强;同一主族,从上到下金属性增强,非金属性减弱。金属性最强的位于左下角的铯,非金属性最强的是位于右上角的氟。
2.金属性越强,单质越容易跟水或酸反应置换出氢,对应的最高价氧化物水化物碱性越强;非金属性越强,跟氢气反应越容易,生成的气态氢化物越稳定,对应的最高价氧化物水化物酸性越强。
七、半径大小规律
1.原子半径:同主族--从上到下逐渐增大;同周期--从左到右逐渐减小(0族除外)。
2.离子半径:同主族--同价离子从上到下逐渐增大;同周期--阴离子半径大于阳离子半径;具有相同的电子层结构的离子--核电荷数越大,离子半径越小。
3.同种元素的各种微粒,核外电子数越多,半径越大;反之,核外电子数越少,半径越小(如)。
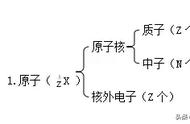
八、主族族序数与周期序数的规律
1.关系式:
主族族序数=最外层电子数;
周期序数=电子层数。
2.设主族族序数为a,周期数为b,则:
a:b<1时,为金属元素,且比值越小,元素的金属性越强;
a:b=1时,为两性元素(H除外),其最高价氧化物为两性氧化物,最高价氧化物的水化物为两性氢氧化物。
a:b>1时,为非金属元素,且比值越大,元素的非金属性越强。