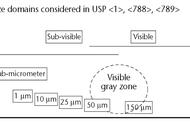
化学键的形成
共价键的形成是通过原子之间电子对的共享来实现的。当两个原子靠近时,它们的电子云开始相互重叠,形成新的分子轨道。这些分子轨道是由原来的原子轨道组合而成。共价键通常被认为是较强的化学键,因为它们涉及到电子的共享。

离子键的形成则是通过正负电荷之间的相互作用而实现的。在离子键中,一个原子失去一个或多个电子,另一个原子则获得这些电子。这种交换导致了两个原子之间的吸引力,从而形成了新的化学键。离子键通常比共价键更强,但也更易于断裂。
金属键的形成是通过金属原子之间的电子云相互重叠而实现的。在金属中,电子云被认为是自由移动的,因为它们可以在整个金属晶体中自由移动。电子云的相互重叠导致了金属离子之间的吸引力,从而形成了金属键。金属键通常具有高强度和高导电性。

电子云重叠区域是化学键形成的基础之一。它指的是两个原子的电子云相互重叠的区域。在化学反应中,当两个原子之间的距离足够接近时,它们的电子云将开始相互作用并发生重叠。这种重叠区域的大小和形状取决于原子之间的距离和原子轨道的形状。

电子云重叠区域的大小和形状对于化学键的强度和方向性具有重要影响。当电子云重叠区域较小时,化学键比较弱,因为它们涉及的电子数量较少。相反,当电子云重叠区域较大时,化学键比较强,因为它们涉及的电子数量更多。此外,电子云重叠区域的形状也决定了化学键的方向性。例如,在共价键中,当两个原子的p轨道重叠时,形成的化学键将具有沿着两个原子轴线的方向性。