(1)活性炭对甲醛也有一定净化能力,是因为活性炭具有_________性。
(2)由图1可知,4种观叶植物净化甲醛百分率由大到小的顺序是_________。
(3)根据图2分析,绿萝在_________时间段内净化甲醛的速率最高。
(4)下列说法正确的是_________。
A 用大量甲醛给海产品保鲜
B 甲醛是重要的工业原料,但使用时需考虑其对环境的影响
C 在甲醛浓度较高的初始阶段,根系和盆土没有起到净化作用
D 通风换气不能降低室内甲醛含量
【答案】 ①. 吸附 ②. 白鹤芋>绿萝>吊兰>袖珍椰子 ③. 0-4h ④. B
【解析】
【详解】(1)活性炭具有吸附性,对甲醛也有一定的净化能力。
(2)根据题中信息可知,4种植物净化甲醛百分率的大小关系是白鹤芋>绿萝>吊兰>袖珍椰子。
(3)绿萝在0-4h时间段内净化甲醛的速率最高。
(4)A、甲醛有毒,不能用大量甲醛给海产品保鲜,不符合题意;
B、甲醛是重要的工业原料,但甲醛有毒,使用时需考虑其对环境的影响,符合题意;
C、在甲醛浓度较高的初始阶段,根系和盆土起到了净化作用,不符合题意;
D、通风换气,能降低室内甲醛含量,不符合题意。
故选B。
三、实验题
20. 请结合图示实验装置,回答下列问题。

(1)仪器①的名称是_________。
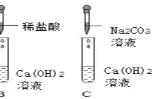
(2)实验室用A装置制取氧气的化学方程式为_________;若用B装置制取O2,应选用的药品是_________。若用E装置收集O2,气体应该从_________口通入(填“a”或“b”)。
(3)已知SO2易溶于水且密度比空气大。实验室用亚硫酸钠固体和浓硫酸反应制备并收集SO2的装置为_________(填字母)。
【答案】 ①. 锥形瓶 ②.
③. H2O2、MnO2 ④. b ⑤. BC
【解析】
【分析】
【详解】(1)仪器①的名称是锥形瓶;
(2)A装置需要加热,试管口有棉花,使用高锰酸钾制取氧气,化学方程式为
;B装置不需要加热,使用H2O2、MnO2制取O2;氧气的密度比空气大,比水小,用E装置收集O2,气体应该从b口通入;
(3)用亚硫酸钠固体和浓硫酸制备SO2,不需要加热,发生装置选择B;SO2易溶于水且密度比空气大,运用向上排空气法收集,收集装置选择C。
21. FeCO3能用于制备可溶性乳酸亚铁补血剂。某化学兴趣小组对其制备和性质进行了如下探究。
【查阅资料】
1.溶液pH大于8.8时,Fe2 完全转化为Fe(OH)2沉淀。
2.FeCO3固体置于潮湿空气中易变质生成Fe(OH)3。
3.FeCl3溶液中滴加KSCN溶液,会出现血红色絮状物;而FeCl2溶液中滴加KSCN溶液,不会出现血红色絮状物。
4.FeCO3是白色固体,难溶于水,能与酸反应,与稀盐酸反应的化学方程式为
。
5.碱石灰的主要成分是NaOH和CaO。
探究一FeCO3的制备
(1)该兴趣小组用pH=11.9的Na2CO3溶液和FeSO4溶液在烧杯中制备FeCO3时,应选用的加料方式是_________(填字母)。
A 将FeSO4溶液与Na2CO3溶液同时加入到烧杯中
B 将FeSO4溶液缓慢加入到盛有Na2CO3溶液的烧杯中
C 将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中
(2)制备FeCO3的化学方程式是_________。
探究二FeCO3的性质探究
【提出问题】久置于空气中的FeCO3固体的成分是什么?
【猜想与假设】猜想1:FeCO3猜想2:FeCO3和Fe(OH)3猜想3:_________
【定性探究】
实验操作 | 实验现象 | 结论 |
取少量固体于试管中,加入足量的稀盐酸 | 固体完全溶解,有气泡产生 | _________不成立 |
取少量上述反应后的溶液于试管中,滴加KSCN溶液 | _________ | 猜想2成立 |
【实验结论】久置于空气中的FeCO3固体的成分是FeCO3和Fe(OH)3。
【定量探究】该兴趣小组为进一步确定固体中FeCO3的质量分数,称取10.0g固体做了如下图所示的补充实验。

(1)装置C中足量NaOH溶液的作用是_________。(用化学方程式表示)
(2)反应结束后,继续通入一段时间N2的目的是_________。
(3)关于上述实验过程,下列说法不正确的是_________。
A 装置A中加入的稀硫酸可用稀盐酸代替
B 装置B的作用是除去水蒸气
C 如果去掉装置D,会使实验结果偏大
D 实验结束后,测得装置C增重0.44g,则固体中FeCO3的质量分数为11.6%
【答案】 ①. C ②.
③. Fe(OH)3 ④. 猜想3 ⑤. 出现血红色絮状物 ⑥.
⑦. 使生成的二氧化碳让氢氧化钠溶液充分吸收 ⑧. A
【解析】
【分析】
【详解】[查阅资料]
①在烧杯中制备FeCO3沉淀时,由于碳酸钠溶液的碱性较强,避免生成氢氧化亚铁沉淀,应选用的加料方式将Na2CO3溶液缓慢加入到盛有FeSO4溶液的烧杯中。
(2)碳酸钠和硫酸亚铁反应生成碳酸亚铁沉淀和硫酸钠,该反应化学方程式:
;
[猜想与假设]久置于空气中的FeCO3固体的成分,可能是FeCO3,可能是FeCO3和Fe(OH)3,可能是Fe(OH)3。
[定性探究]取少量固体于试管中,加入足量稀盐酸,固体完全溶解,有气泡产生,说明含有FeCO3,猜想3不成立。
取少量上述反应后的溶液于试管中,滴加KSCN溶液,出现血红色絮状物,说明猜想2成立。
[定量探究](1)该兴趣小组为进一步确定固体中FeCO3的质量分数,称取10.0g固体做了如下图所示的补充实验。装置C中足量NaOH溶液的作用是吸收生成的二氧化碳,化学方程式是
;
(2)反应结束后,继续通入一段时间N2的目的是使生成的二氧化碳让氢氧化钠溶液充分吸收。
(3)A、稀盐酸有挥发性,装置A中加入的稀硫酸不能用稀盐酸代替,说法不正确;
B、浓硫酸作干燥剂,装置B的作用是除去水蒸气,说法正确;
C、如果去掉装置D,空气中的二氧化碳会被氢氧化钠吸收,会使实验结果偏大,说法正确;
D、实验结束后,测得装置C增重0.44g,说明生成二氧化碳的质量是0.44g,固体中FeCO3的质量是1.16g,其质量分数分数为11.6%,说法正确;
答案:A。
四、计算题
22. 向40.0gBaCl2溶液中滴加一定溶质质量分数的Na2CO3溶液,实验过程中产生沉淀的质量与加入Na2CO3溶液的质量关系如下图所示。