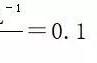今天这节课我们要一起来学习化学平衡状态的判定,本节课主要介绍几种特别重要的方法:

方法一、利用正反应速率等于逆反应速率不等于零来判断化学平衡状态。比如我们看到屏幕显示的一个任意的可逆反应,那能够说明这个反应达到平衡状态的有哪几条呢?请大家和我一起来分析。比如我们来看单位时间内生成a的,同时生成三倍的b。生成a代表反应逆向进行,生成b代表反应逆向进行。这里没有体现出正和逆两个方向,所以一是错误的。
第二个,c的生成速率和c的分解速率是相等的,c的生成代表着反应正向进行,而c的分解代表着反应逆向进行,当两者的速率相等的时候,我们认定它达到了化学平衡状态。
第三个,正向的a的速率三倍的等于逆向的b的速率,刚好符合方程式的系数比,同时又有正和逆两个方向,因此第三个也是正确的。
我们再看最后一个,单位时间内生成n摩尔a的同时生成了二n摩尔的c,生成a代表反应逆向进行,生成c代表反应正向进。有证有逆,同时还符合方程式的系数比,所以第四个也是正确的。那我们来总结一下怎么利用速率的关系去判断化学平衡状态。对于同一个物质而言,比如我们例题当中的第二个都是在研究c这种物质,那么这种物质的生成速率等于它的分解速率,是可以作为判定的依据的,但是对于不同的物质而言,速率之比要符合方程式当中的计量数之比,但必须是不同方向的速率,所以一是错的,四是对的。

第二个方法,我们可以利用反应混合物各组分的浓度保持不变来判断化学平衡状态。比如我们看这道题,能够判定达到平衡的标志是哪一个呢?
A.c的生成速率和c的分解速率相等是正确的,和立体和刚刚的那个方法是相同的。
B.a、b、c的浓度不再改变,这也是正确的。大家都知道,当反应达到平衡状态之后,体系内各组分的浓度是不再会发生改变的,所以b也是对的。单位时间内生成n摩尔,a,同时生成三n摩尔b,虽然符合方程式的系数比,但是是同向的,没有提到两个方向,因此c是错误的。
d选项无论这个反应达没达到平衡,abc的分子系数比都是符合方程式的系数之比的。所以我们要提醒大家特别注意的是,反应物和生成物的分子数或者是浓度达到化学剂量数之比不一定。就可以作为判据,一定要强调浓度不再发生改变,而不是浓度相等或者是浓度符合一定的系数比,同时也要注意分子数之比是不可以作为判断依据的。

第三个方法,我们就要教大家一种,可变量不变就达到了平衡。依然是以这样一个方程式为例,当下列物理量不再发生变化的时候,哪一个可以表明这个反应达到了化学平衡状态呢?证据选项是二和四,请看一、混合气体的总物质的量。
大家都知道,对于这样一个反应而言,它的总物质量是不会发生改变的。而单一的比如第二个b的物质量浓度,某一个具体的物质的浓度不再发生改变的时候,我们可以判定反应已经达到了平衡状态。
第三个,容器内气体的压强。压强虽然可以表征气体的浓度,但是它依然没有指定是哪一种气体的压强。同时我们可以把压强转换一个思考的角度,理解成浓度,所以一和三讲的都不是判据。
四、混合气体的密度,密度是等于质量除以体积,这里边体积是不变的,质量也不会发生改变。所以这道题总结的时候就要请大家关注化学平衡状态的一种宏观标志,当某一个变量不再发生改变的时候,我们就认定它达到了平衡,而哪些变量就要具体情况具体分析,比如混合气体的总的物质的量、还有总的密度、还有平均密度、还有平均相对分子质量和气体的体积分数,都是可以作为变量的。分析的时候我们要关注前、后各物质的状态和系数,再结合公式进行判断。
以上就是今天的全部内容,如果有疑问可以留言,也欢迎大家积极转发。
,