“2021 年 4 月我的女儿出生,5 月完成线上答辩,6、7 月完成外管局续签。这些喜悦、紧张、焦急穿插在整个课题研究当中,使得那段经历无比宝贵。”说这话的是来自中国的青年学者孙祥。
在他完成上述课题期间,孙祥一连多了两个 title——博士和父亲。其博士毕业于德国马克思普朗克煤炭研究所。目前,他在英国剑桥大学进行博士后研究,研究方向是超分子领域。

图 | 孙祥(来源:孙祥)
在前面提到的工作里,孙祥发展了光催化α-烯烃的反马氏氢氯化反应和反马氏氢硝酸酯化反应。
α-烯烃,指的是具有 CnH2n 化学通式的端烯,它主要源于乙烯的寡聚,是一类具有广泛应用的工业产品。不同于苯乙烯,α-烯烃更难被氧化,也不容易发生自由基加成反应,这导致很多已经报道的苯乙烯类化合物的氢官能团化反应不适用于α-烯烃。
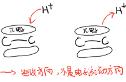
那么,反马氏加成规则、以及所对应的马氏加成规则分别是什么?马氏加成,是很多人在高中化学课本上接触到的规则。早在 1869 年,俄国科学家马尔科夫尼科夫(Markovnikov,Vladimir Vasilevich)发现,卤化氢等亲电试剂与不对称烯烃发生加成反应时,氢加在含氢较多的双键碳原子上,卤素加在含氢较少的双键碳原子上。
马氏加成规则背后的机理,在于拥有更多取代基的碳正离子更稳定。而反马氏加成则会得到区域选择性相反的产物。
在反马氏加成反应中,Brown 硼氢化反应带来了广泛的应用, 该反应依旧经历碳正离子中间体,因为此时硼原子显电正性,会与双键发生亲电加成。
更多的反马氏加成的例子是经历自由基加成机理,因为拥有更多取代基的碳自由基更稳定,比如反马氏氢溴化。
溴化氢在过氧化物的存在下生成溴自由基,溴自由基加到氢较少的双键碳上时,形成较稳定的碳自由基。随后,碳自由基再攫取溴化氢的氢原子,从而得到反马氏氢溴化产物以及另一分子溴自由基。
然而,反马氏氢溴化的条件并不适用于氯化氢以及其他含氧酸。因此,对α-烯烃的反马氏氢氯化从未实现。
尽管都属于无机强酸,但是与溴化氢相比,氯化氢的的氢氯键解离能同时高于氢溴键和碳氢键,这就导致碳自由基无法攫取氯化氢的氢原子。
同时,氯离子和其他含氧酸根离子具有更高的还原电势,这也导致相对应的氯自由基和含氧酸根自由基并不容易产生。
为此,孙祥和所在团队使用吖啶类化合物作为光催化剂前体,与氯化氢接触时形成具有光氧化还原活性的离子对,被光激发后,阴阳离子间发生单电子转移,生成氯自由基。
同时,将氯化氢从其水溶液中转移至溶有α-烯烃的有机非极性溶剂中,这一离子对还发挥了相转移催化剂的作用。
为了解决碳自由基无法攫取氯化氢的氢原子这一问题,该课题组使用苯硫酚或二苯硫醚作为氢原子转移试剂,原因在于氢硫键具有较低的解离能。
当氯自由基加成到α-烯烃上之后,所形成的碳自由基攫取苯硫酚的氢原子,进而会形成反马氏氢氯化产物。随后,吖啶自由基与硫自由基发生单电子转移,从而完成催化剂再生。
整个过程中,除了溶剂与光外,其余添加剂均是催化量。这一催化体系也适用于反马氏氢硝酸酯化反应,这预示着它对于其他含氧酸具有兼容性。
需要说明的是,使用吖啶类化合物作为光催化剂前体的相关成果,此前已经被美国德克萨斯大学团队报道过;使用苯硫酚作为氢原子转移试剂的相关成果,则已被来自美国北卡罗来纳大学和美国普林斯顿大学的课题组报道过。
一定程度来说,孙祥等人的工作并没有刷新已有认知,然而他们的相转移-电子转移-氢转移催化体系实现了反马氏氢氯化反应,填补这一反应的空白。
另外,该工作也向α-烯烃的反马氏水合反应迈进了一步。α-烯烃的反马氏水合可以制备脂肪伯醇,而脂肪伯醇是一类具有广泛应用价值的工业产品。
目前,脂肪伯醇主要通过 Ziegler 法制备,这是一个由烷基铝试剂参与的乙烯聚合氧化过程。在生成脂肪伯醇的同时,会消耗化学当量的铝试剂。如果使用α-烯烃和水为原料来实现催化反马氏水合反应,必将带来重要的应用价值。
概括来说,α-烯烃与无机酸反应之后通常会得到马氏加成产物,而孙祥和所在团队开发了非常高效的α-烯烃反马氏氢氯化与氢硝酸酯化反应,突破了已知化学反应的界限。
其中,现场产生的具有光氧化还原活性的离子对,既起到了电子转移催化作用,又起到了相转移催化作用,在概念上既先进、又新颖。在该催化体系里,除了使用溶剂与光之外,无需额外添加化学当量的试剂。
该成果中的反马氏氢氯化与反马氏氢硝酸酯化反应,展示了良好的底物适用性与官能团兼容性,能被用于药物活性分子的合成与修饰。此外,孙祥和同事认为相转移-电子转移-氢转移这一催化模式,也能适用于其他无机酸的反马氏加成反应以及反马氏水合反应。
近日,相关论文以《α-烯烃的可见光光催化反马尔可夫尼科夫氢氯化和硝基加氢反应》(Anti-Markovnikov hydrochlorination and hydronitrooxylation of α-olefins via visible-light photocatalysis)为题发在 Nature Catalysis 上。

图 | 相关论文(来源:Nature Catalysis)
Jungwon Kim 和孙祥是第一作者,德国马克思普朗克煤炭研究所托拜厄斯·里特(Tobias Ritter)教授担任通讯作者 [1]。
尽管该研究并未实现α-烯烃的反马氏水合反应,但却始于对α-烯烃的反马氏水合反应的探索。
2019 年 9 月,孙祥向当时的导师提交了反马氏水合反应的研究计划,虽然那份计划在机理上具有可行性,但是经过几个月的尝试,并没有得到积极的结果。
直到 2021 年 2 月,在孙祥完成博士论文、等待博士答辩的时间里,他又开始了对于反马氏水合反应的摸索,期间尝试了更多的催化方案,借此发现了α-烯烃反马氏氢氯化产物。
在调研文献之后,他暂时搁置了反马氏水合反应的研究,确定了反马氏氢氯化的课题。其表示:“由于我即将完成博士答辩离组,时间比较有限,这时 Jungwon Kim 博士也加入课题,他发现该催化体系也适用于反马氏氢硝酸酯化的反应。”
2021 年 3 月至 7 月,他们对反应条件进行了摸索,同时不断优化反应的产率与区域选择性。在孙祥离组之后,Kim 博士与另一位论文作者鲍里斯·亚历山大·范·德·沃普(Boris Alexander van der Worp)进行了底物范围的考察和详细的机理研究。后在,2022 年 3 月所有作者一起完成了论文撰写并进行投稿。

(来源:Nature Catalysis)
尽管孙祥已经离开读博时的课题组,但是还会有学弟学妹继续探索α-烯烃的反马氏水合反应。
水不同于盐酸和硝酸,在该反应体系下不会生成类似的离子对,同时氢氧根也很难被氧化成氢氧根自由基,似乎该催化体系不可能实现反马氏水合。
但是,换个思路就能实现反马氏氢硝酸酯化反应,其它的含氧酸对α-烯烃的反马氏加成应该也容易实现。那么是否存在某种合适的含氧酸,在生成酯化产物之后很容易被水解成伯醇?这也将是孙祥此前团队的后续研究重点。
参考资料:
1.Kim, J., Sun, X., van der Worp, B.A.et al. Anti-Markovnikov hydrochlorination and hydronitrooxylation of α-olefins via visible-light photocatalysis. Nat Catal 6, 196–203 (2023). https://doi.org/10.1038/s41929-023-00914-7
,