第一章 原子结构与性质
1、能层和能级
(1)能层和能级的划分
①在同一个原子中,离核越近能层能量越低。
②同一个能层的电子,能量也可能不同,还可以把它们分成能级 s、p、d、f,能量由低 到高依次为 s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f⋯⋯可容纳的电子数依次是 1、3、5、7⋯⋯的两倍。
⑤能层不同能级相同,所容纳的最多电子数相同。
能层:原子户外的电子是分层排布的,每一层都叫做能层,可以分为K.L.M.N.O.P.Q7个能层
每个能层最多能排2n^2 个电子(但是没有这么元素,目前最多的是N层有32个)
每个能层可以为多个能级,有能级的划分是因为容电子能量不同,一般来说,电子先排在能量较低的轨道,再排能量高的轨道。
(2)能层、能级、原的轨道之间的关系
每能层所容纳的最多电子数是:2n2(n:能层的序数)。

2、构造原理
(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主 要依据之一。
(3)不同能层的能级有交错现象,
如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、 E(6d)> E(7s)、E(4f)>E(5p)、 E(4f)> E(6s)等。
原子轨道的能 量关系是:
ns<( n-2)f < (n-1)d <np
(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应 着每个周期的元素数目。
在多电子原子的电子排布中:
1.各能层最多容纳的电子数为 2n2 ;
2.最外层 不超过 8 个电子;
3.次外层不超过 18 个电子;
4.倒数第三层不超过 32 个电子。
(5)基态和激发态
①基态:基态是指在正常状态下,原子处于最低能级,这时电子在离核最近的轨道上运动的这种定态。基态的概念是基于能层原理、能级概念、能量最低原理而来的。
②激发态:激发是在任意能级上能量的提升。在物理学中有对于这种能级有专门定义:往往与一个原子被激发至激发态有关。
在量子力学中,一个系统(例如一个原子,分子或原子核)的激发态是该系统中任意一个比基态具有更高能量的量子态(也就是说它具有比系统所能具有的最低能量要高的能量)。
③原子光谱:原子光谱,是由原子中的电子在能量变化时所发射或吸收的一系列波长的光所组成的光谱。原子吸收光源中部分波长的光形成吸收光谱,为暗淡条纹;发射光子时则形成发射光谱,为明亮彩色条纹。两种光谱都不是连续的。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。

3、电子云与原子轨道
(1)电子云:电子在核外空间做高速运动,没有确定的轨道。因此,人们用“电子云” 模型来描述核外电子的运动。“电子云”描述了电子在原子核外出现的概率密度分布,是核 外电子运动状态的形象化描述。(电子是一种微观粒子,在原子如此小的空间(直径约10⁻¹⁰m)内运动,核外电子的运动与宏观物体运动不同,没有确定的方向和轨迹,只能用电子云描述它在原子核外空间某处出现机会(几率)的大小。)
(2)原子轨道:不同能级上的电子出现 概率 约为 90%的电子云空间轮廓图 称为原 子轨道。s电子的原子轨道呈 球形对称, ns能级各有 1 个原子轨道;p 电子的原子轨道呈纺 锤形, np 能级各有 3 个原子轨道,相互垂直(用 px、py、pz表示);nd 能级各有 5 个原子 轨道;nf 能级各有 7 个原子轨道。(原子轨道,又称轨态,物理学术语,是以数学函数描述原子中电子似波行为。此波函数可用来计算在原子核外的特定空间中,找到原子中电子的几率,并指出电子在三维空间中的可能位置)
1、第一层不超过2个,第二层不超过8个;
2、最外层不超过8个。每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;
3、最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
4、最低能量原理:电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
5、泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
6、洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。

02
元素周期表和元素周期律
1、元素周期表的结构
1.元素在周期表中的位置由原子结构决定:
2.原子核外的能层数决定元素所在的周期,
3.原子的价电子总数决定元素所在的族。
(1)原子的电子层构型和周期的划分
周期是指能层(电子层)相同,按照最高能级组电子数依次增多的顺序排列的一行元素。即元素周期表中的一个横行为一个周期, 周期表共有七个周期。
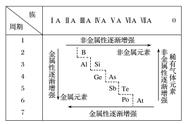
同周期元素从左到右 (除稀 有气体外),
元素的金属性逐渐减弱,非金属性逐渐增强。
(2)原子的电子构型和族的划分 族是指价电子数相同 (外围电子排布相同) ,按照电子层数依次增加的顺序排列第一列 元素。即元素周期表中的一个列为一个族(第Ⅷ族除外)。共有十八个列,十六个族。同主 族周期元素从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
(3)原子的电子构型和元素的分区 按电子排布可把周期表里的元素划分成 5 个区,分别为 s区、p 区、d 区、f 区和 ds 区, 除 ds 区外,区的名称来自按构造原理最后填入电子的能级的符号。
2、元素周期律
1.元素的性质随着核电荷数的递增发生周期性的递变, 叫做元素周期律。
2.元素周期律主要体现在核外电子排布、原子半径、主要化合价、金属性、非金属性、第一电离能、电负性等 的周期性变化。
3.元素性质的周期性来源于原子外电子层构型的周期性。
(2)微粒半径的比较方法
①同一元素:一般情况下元素阴离子的离子半径大于相应原子的原子半径, 阳离子的离 子半径小于相应原子的原子半径。
②同周期元素(只能比较原子半径):随原子序数的增大,原子的原子半径依次减小。
如:Na>Mg>Al>Si>P>S>Cl
③同主族元素 (比较原子和离子半径) :随原子序数的增大, 原子的原子半径依次增大。
如:Li<Na<K<Rb<Cs ,F-<Cl -<Br-<I
④同电子层结构(阳离子的电子层结构与上一周期 0 族元素原子具有相同的电子层结 构,阴离子与同周期 0 族元素原子具有相同的电子层结构):随核电荷数增大,微粒半径依 次减小。
如:F-> Na >Mg 2 >Al 3
(3)元素金属性强弱的判断方法
,