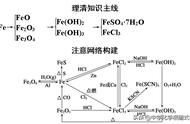
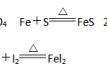2.特别提示 (1)Fe3O4的组成可用 FeO·Fe2O3表示,但不代表 Fe3O4是由 FeO 和 Fe2O3组成的混合物,Fe3O4 有固定的组成,是一种纯净物。
(2)由于 Fe3O4与非氧化性酸反应,生成铁盐和亚铁盐,故 Fe3O4不属于碱性氧化物,而 FeO、 Fe2O3属于碱性氧化物
3.铁的氢氧化物
(1)铁的氢氧化物的制备
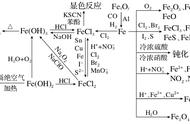
实验室制备氢氧化铁和氢氧化亚铁如下图所示:

①图甲实验中观察到的现象是有 色沉淀生成,反应的离子方程式是 Fe 3 + +3OH - ====Fe(OH)3↓。
②图乙实验中先观察到有 色沉淀生成,在空气中迅速变成灰绿色,最后变成 色,有关反 应的离子方程式是:Fe 2++2OH -===Fe(OH)2↓(白色); 4Fe(OH)2+O2+2H2O========4Fe(OH)3
③氢氧化亚铁制备注意事项 在实验室制备氢氧化亚铁时,一定要用 现配 的亚铁盐和先加热驱赶 氧气 后的氢氧化钠溶 液,且滴管末端插入试管内的液面下,再滴加氢氧化钠溶液,也可以在反应液面上滴加植物 油或苯等物质进行液封,以防止氢氧化亚铁与氧气接触。
(2)Fe(OH)2和 Fe(OH)3性质

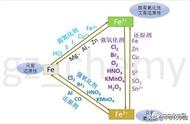
4.铁盐和亚铁盐 (1)Fe 2+、Fe 3+的检验方法
①观察法:浅绿色溶液中含有 Fe 2+ ;棕黄色溶液中含有 Fe 3+ 。
②加碱法:若产生的白色沉淀迅速变为灰绿色,最后变为红褐色的为 Fe 2+ ;若直接产生 红褐色沉淀的为 Fe 3+ 。
③加 KSCN:无明显现象,再加新制氯水溶液变红色的为 Fe 2+;若溶液直接变红色的为 Fe 3 +。 (2)Fe 2+与 Fe 3+的转化
如下图所示

①在盛有氯化铁溶液的试管中加适量铁粉振荡后,溶液变成 浅绿 色,再加 KSCN 溶液, 溶液 不变色 ,再加入氯水后,溶液变成 红 色。
②上述实验中有关反应的离子方程式是 2Fe 3++Fe===3Fe 2+、2Fe 2++Cl2===2Fe 3++2Cl-。
③由上述实验可知:Fe 3+遇到较强的还原剂,会被还原成 Fe 2+;Fe 2+在较强氧化剂的作用下, 会被氧化成 Fe 3+。
(3)铁盐和亚铁盐的化学性质 写出下列反应的离子方程式