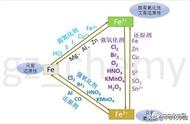
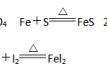1. 知识网络构建
2. 重要反应必练
写出下列反应的方程式,是离子反应的写出离子方程式。
①铁丝点燃后伸入纯氧中的反应
②Fe粉在高温下和水蒸气的反应________________________
③铁的氧化物与盐酸的反应:FeO和稀HCl的反应
④Fe2O3和稀HCl的反应
⑤Fe3O4和稀HCl的反应
⑥铁的氢氧化物的制备:新制FeSO4溶液中滴入NaOH溶液
⑦FeCl3溶液中滴入NaOH溶液
⑧Fe(OH)2长时间置于空气中__________________________
⑨Fe(OH)3加热
⑩FeCl3溶液和KSCN溶液的反应
⑪FeCl3溶液中加入铁粉、KSCN溶液
⑫FeCl3溶液中加入铁粉、KSCN溶液后,取上层清液加氯水
⑬Fe和过量稀HNO3的反应_____________________________
⑭过量铁粉和稀HNO3的反应____________________________
⑮FeCl3溶液和Cu的反应____________________________
⑯Fe2O3和CO的反应_________________________________
⑰Fe2O3和Al在高温下反应_________________________
他山之石:
每周记背
铝 铜 金属材料
八、规律方法总结
1.既能与强酸溶液反应又能与强碱溶液反应的物质
⑴单质:Al等;⑵两性氧化物:Al2O3等;
⑶两性氢氧化物:Al(OH)3等;
⑷弱酸的铵盐:如CH3COONH4、(NH4)2CO3、(NH4)2S等;
⑸多元弱酸的酸式盐:如NaHCO3、NaHSO3 NaHS等。
【注意】SiO2可以与NaOH溶液反应也可以与HF反应,但HF是弱酸。
2.不用其它试剂,用互滴法就可以鉴别的溶液有:
⑴CO32-与H ,如Na2CO3溶液与盐酸;
⑵Al3 与OH-,如AlCl3溶液与NaOH溶液;
⑶[Al(OH)4]- 与H ,Na[Al(OH)4]溶液与稀盐酸。
3. Mg2 和Al3 的检验方法:
(1)加入过量的NaOH溶液,若产生白色沉淀则含有Mg2 ;
(2)加入过量的NaOH溶液,若先产生白色沉淀,后白色沉淀溶解,则含有Al3 。(限于中学化学学习范围)
4. 比较金属与酸的反应产生H2的量的多少的方法
(1)先看是否产生H2 ,淘汰浓硫酸、硝酸等不产生氢气的选项;
(2)看过量情况,用少量物质计算;
(3)注意过量Na与水反应的情况。
5.典型的不能一步转化的物质
(1)SiO2→H2SiO3 ;
(2)CuO→Cu(OH)2;Fe2O3→Fe(OH)3;
Al2O3→Al(OH)3;
(3)N2→NO2; S→SO3 等等。
6.有关Al(OH)3沉淀的生成和溶解的计算
(1)关注Al3 和OH-的物质的量之比,确定铝元素的存在形式;
(2)关注图像中的拐点的数据和意义。如根据溶解Al(OH)3消耗的NaOH的物质的量即可求出Al(OH)3的物质的量,继而求出生成Al(OH)3需要的NaOH的物质的量。
(3)充分利用元素守恒关系巧解。
九、铜与金属材料
1.铜的常见化合物的颜色和溶解性
CuO—黑色、难溶;Cu2O—红色、难溶;
Cu2S—黑色、难溶;CuSO4—白色、易溶;CuSO4·5H2O—蓝色、易溶;Cu2(OH)2CO3—绿色、难溶;Cu(OH)2—蓝色、难溶。
2.铜及其化合物的有关反应方程式
(1)2Cu O2 =△ 2CuO;
(2)2Cu O2 H2O CO2=Cu2(OH)2CO3,
(3)2Cu S =△ Cu2S;
(4)Cu Cl2点燃CuCl2
(5)Cu 2H2SO4(浓) =△ CuSO4 SO2↑ 2H2O;
(6)Cu 4HNO3(浓) = Cu(NO3)2 2NO2↑ 2H2O
Cu 4H 2NO3- = Cu2 2NO2↑ 2H2O
(7)3Cu 8HNO3(稀)=3Cu(NO3)2 2NO↑ 4H2O;
3Cu 8H 2NO3- = 3Cu2 2NO↑ 4H2O
(8)2FeCl3 Cu=2FeCl2 CuCl2;
2Fe3 Cu=2Fe2 Cu2
(9)CuO+2HCl=CuCl2+H2O
(10)H2+CuO =△ Cu+H2O;
(11)4CuO高温 2Cu2O+O2↑;
(12) Cu2(OH)2CO3 =△ 2CuO H2O CO2↑。
3.金属的分类
(1)在冶金工业上,分为黑色金属材料和有色金属材料两大类。黑色金属:Fe、Cr、Mn以及它们的合金,有色金属:除Fe、Cr、Mn以外的所有金属。
(2)银不能与盐酸、稀硫酸反应,但却能溶解在硝酸等强氧化性酸中,如3Ag+4HNO3 (稀)=3AgNO3+NO↑+2H2O
4.合金:合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。一般来说,合金与其成分金属相比,熔点低 ,硬度大,合金的性质并不是各成分金属性质的总和。
,