学习目标
1.了解质量数和 A ZX 的含义,掌握核电荷数、质子数、中子数、质量数之间的相互关系。 2.知道元素、核素、同位素的含义,并能比较它们的不同。
3.知道碱金属元素、卤族元素的结构和性质,能从原子结构角度解释同主族元素性质的递变 规律,形成“结构决定性质”的观念,强化宏观辨识与微观探析的学科核心素养。
知识导学
知识清单 知识点 1 原子(或离子)构成微粒间的关系
1.原子符号

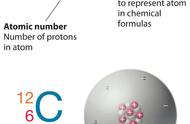
A ZX 表示的意义是质子数为 Z,质量数为 A 的 X 元素的一种原子。
2.原子构成微粒数的确定
质量数(A)=质子数(Z)+中子数(N)
(1) 14 6C 的质量数为 14,质子数为 6,中子数为 8。
(2) 39 1 K 的质量数为 39,中子数为 20,核外电子数为 19。
(3)核内中子数为 12,核外电子数为 11 的钠原子符号为 23 11Na。
例 1.用 A ZX 表示原子: (1)A ZX 原子的中子数 N=________。
(2)AXn+共有 x 个电子,则该阳离子的中子数为__________。
(3)AXn-共有 x 个电子,则该阴离子的中子数为__________。
(4)A2-原子核内有 x 个中子,其质量数为 m,则 n g A2-所含电子的物质的量为_______。
(5)与阳离子 23 11X +核外电子数相等的原子是__________(填元素符号)。
例 2.已知 R 2+核外有 a 个电子,核内含有 b 个中子,表示 R 原子符号正确

例 3.某原子 X 的核内中子数为 N,质量数为 A,它与原子 2H 构成 2HmX 分子。a g 2HmX 所 含质子的物质的量是( )

知识点 2 元素、核素、同位素
1.相关概念