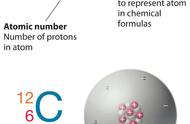
(1)写出氯元素相对原子质量的计算表达式:
34.969×75.77%+36.966×24.23%≈35.45。
(2)写出氯元素近似相对原子质量的计算表达式:
35×75.77%+37×24.23%≈35.48。
5.元素、核素、同位素与同素异形体的比较

例 1.意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由 4 个氧原子构成的氧分 子 O4,下列说法正确的是( )
A.O4和 O2互为同位素
B.O4转化为 O2是物理变化
C.18O 是氧元素的一种核素,它的中子数是 8
D.同温同压下,等体积的 O4气体和 O2气体含有相同的分子数
例 2.重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有 1 个电子
B.1H 与 D 互称同位素
C.H2O 与 D2O 互称同素异形体 D.1H18 2 O 与
D16 2 O 的相对分子质量相同
例 3.某元素的相对原子质量的计算式为 34.969×75.77%+36.966×24.23%≈35.453,下列 说法错误的是( )
A.该元素有两种同位素
B.75.77%是某种同位素的丰度
C.35.453 是该元素的平均相对原子质量
D.36.966 表示某种同位素的质量数
知识点 3 碱金属元素
1.碱金属元素的原子结构

(1)由上表可知: 在元素周期表中,碱金属元素原子的最外层电子数相同,随核电荷数的增大,电子层数依次 增多,原子半径逐渐增大。
(2)碱金属元素的原子最外层电子数为 1,易失去电子而具有较强的金属性,其单质与钠类似, 易与氧气、水等反应。
2.碱金属单质的化学性质
(1)钠、钾与氧气反应

①实验现象:都能在空气中燃烧,钠产生黄色火焰,钾产生紫色火焰(透过蓝色钴玻璃),钾 燃烧更剧烈。
②反应方程式: