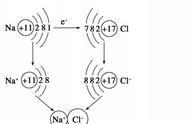
☞一、常用化学计量
考点一 阿伏加德罗常数及其应用
1. 与气体摩尔体积22.4 L/mol相关的NA的应用
(1)非标准状况下的气体和标准状况下的非气体均不适用22.4 L/mol进行物质的量的计算;
(2)常见物质在标准状况下的状态:溴、氟化氢、水、苯、四氯化碳、二氯甲烷、三氯甲烷、甲醇、乙醇,碳原子数大于4的烃(除新戊烷),均为液体;三氧化硫为固体。
2.与物质的组成相关的NA的应用
(1)稀有气体、臭氧、白磷、硫单质中的原子数目;
(2)一定质量含核素的物质中的质子、中子、电子或原子的数目;
(3)过氧化钠中的阴阳离子个数比;
(4)等物质的量的羟基与氢氧根离子所含质子、电子或原子数目;
(5)等质量的最简式相同的物质、同素异形体、N2与CO、NO2与N2O4等具有的原子、分子数目;
(6)一定物质的量的有机物中共价键的数目(苯环、萘环中无碳碳双键);
(7)一定物质的量的SiO2中含Si-O键、晶体硅中Si-Si键、金刚石(或石墨)中1 mol C中含C-C键、1 mol P4中含P-P键的数目;[来源:Z。xx。k.Com]
(8)离子化合物中无分子;
(9)一个胶粒中含有多个分子。
3.与化学反应有关的NA的应用
(1)歧化反应转移电子数目:过氧化钠与二氧化碳的反应、过氧化钠与水的反应、氯气与氢氧化钠溶液(冷稀、浓热)的反应;
(2)变价金属(铁、铜)与强弱氧化剂(氯气/溴单质、硫/碘单质)反应类;
(3)铁与浓/稀硝酸反应,铜与浓/稀硝酸反应类;
(4)足量/不足量铁与稀硝酸、足量铁与浓硫酸反应类;
(5)足量高锰酸钾与浓盐酸、足量二氧化锰与浓盐酸反应类;
(6)浓硫酸与金属活动性顺序表中氢前面的金属反应生成氢气类;
(7)进行过程中反应的终止或方向的改变。
4.可逆反应和平衡理论相关NA的应用
(1)是否有弱离子的水解,是否有弱电解质的电离平衡;
(2)隐含反应:二氧化氮和四氧化二氮之间的相互转化,氯气和水反应、氨气和水反应、醋酸电离等等。
1.NA为阿伏加德罗常数的值,下列说法正确的是( )
A.46 g乙醇中含有的化学键数为7 NA
B.1 mol氯气和足量NaOH溶液反应转移电子数为2 NA
C.1 mol OH- 和1 mol -OH(羟基)中含有的质子数均为 9 NA
D.10 L 0.1 mol·L-1 的Na2CO3溶液中,Na 、CO32- 总数为3 NA
【答案】C
2.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4L己烷中共价键数目为19NA
B.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
C.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
【答案】B
【解析】标准状况下己烷是液体,不适合标准状况下气体摩尔体积,A项错误;一个CO2分子和一个O2分子均含有两个氧原子,NA个混合物分子中的氧原子数为2NA,B项正确;根据3Cl2 2Al=2AlCl3可知,1mol铝与1.5mol完全反应转移的电子数为3NA,常温常压下33.6L氯气的物质的量小于1.5mol,故27g铝不能完全反应,转移电子数小于3NA,C项错误;1L浓度为1mol·L-1的溶液中n(Na2CO3)=1mol,因CO32-发生水解,故N(CO32-)〈 NA,D项错误。
3.(2015·广东卷)设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 23 g Na与足量H2O反应完全后可生成NA个H2分子
B.1 mol Cu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4 L N2和H2混合气中含NA个原子
D.3 mol单质Fe完全转变为Fe3O4,失去8NA个电子
【答案】D
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B.常温下,pH=12的Na2CO3溶液中含有的OH-数为0.01NA
C.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA
D.7.8 g Na2O2中含有的阴离子数为0.2NA
【答案】A
【解析】C2H4、C3H6的最简式相同,14 g混合气体中含有的碳原子的质量是12 g,含有的碳原子数目为NA,A正确;pH=12的Na2CO3溶液的体积不清楚,含有的OH-离子数无法求算,B错误;标准状况下,0.56 L丙烷的物质的量为0.025 mol,含有共价键的数目为0.25NA,C错误;7.8 g Na2O2的物质的量为0.1 mol,含有的阴离子数为0.1NA,D错误。
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,46 g NO2与N2O4的混合气体中含有的分子总数为NA
B.0.1 mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA
C.25 ℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
D.一定量的钠与8 g氧气作用,若两者均无剩余,转移的电子数为NA
【答案】B
【解析】采用极值法来判断:假设46 g 气体全部为NO2,则NO2的物质的量n=1 mol,分子个数为NA个;假设46 g 气体全部为N2O4,则N2O4的物质的量n=0.5 mol,则分子个数为0.5NA个,而现在是46 g NO2与N2O4的混合气体,故气体的分子个数介于0.5NA~NA之间,故A错误;1 mol乙烯和1 mol乙醇燃烧均消耗3 mol氧气,故0.1 mol乙烯和乙醇的混合物完全燃烧所消耗O2的物质的量为0.3 mol,分子数为0.3NA,故B正确;溶液的体积不确定,故OH-的数目无法确定,故C错误;8 g氧气的物质的量n=0.25 mol,而氧气与钠反应时,根据反应条件的不同,常温下生成Na2O,氧元素为-2价,故0.25 mol氧气得 1 mol电子;若在加热时生成Na2O2,氧元素为-1价,则0.25 mol氧气得0.5 mol电子,故D错误。
6.(2016·全国卷Ⅰ)设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.14 g乙烯和丙烯混合气体中的氢原子数为2NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.1 mol Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
【答案】A
7.设NA 为阿伏加德罗常数的值。下列说法正确的是( )
A.0.56 L 甲烷中含有的共价键数为0.1NA
B.标准状况下,8 g SO3含有的氧原子数为0.3NA
C.反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每 1 mol KClO3参与反应,转移的电子数为6NA
D.pH=1的稀硫酸中含有的H+数为0.1NA
【答案】B
【解析】没有告诉在标准状况下,题中条件无法计算 0.56 L 甲烷的物质的量及共价键数目,故A错误;8 g SO3含有 0.1 mol 三氧化硫,0.1 mol 三氧化硫含有的氧原子数为0.3NA,故B正确;反应KClO3+6HCl,FKCl+3Cl2↑+3H2O中,1 mol 氯酸钾完全反应被还原成0价的氯气,转移了 5 mol 电子,转移的电子数为5NA,故C错误;没有告诉pH=1的稀硫酸的体积,无法计算溶液中氢离子的数目,故D错误。
8.(2018课标Ⅱ)NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124 g P4中所含P—P键数目为4NA[来源:学&科&网Z&X&X&K]
B. 100 mL 1mol·L−1FeCl3溶液中所含Fe3 的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
【答案】C
9.(2017课标Ⅱ)阿伏加德罗常数的值为NA。下列说法正确的是( )
A.1L0.1mol/L NH4Cl溶液中,的数量为0.1NA
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1 NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2 NA
D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 NA
【答案】D
【解析】A、NH4+是弱碱根离子,发生水解,因此NH4+数量小于0.1NA,故A错误;B、2.4gMg为0.1mol,与硫酸完全反应后转移的电子的物质的量为2.4×2/24mol=0.2mol,因此转移电子数为为0.2NA,故B错误;C、N2和O2都是分子组成,标准状况下,2.24L任何气体所含有的分子数都为0.1NA,故C错误;D、反应前后系数之和相等,即反应后分子总物质的量仍为0.2mol,分子数为0.2NA,故D正确。
10.设NA 为阿伏伽德罗常数的值。下列说法错误的是( )
A.常温常压下,3.2 g O2中所含的原子数为0.2NA
B.标准状况下,22.4 L SO3中含有SO3分子数为NA
C.室温下,1 mol CH4中含有5NA 原子
D.常温常压下,1 mol CO2与SO2的混合气体中含氧原子数为2NA
【答案】B
【解析】解析:标准状态时SO3不是气态,B错误。
,