来源:国际呼吸杂志2020年第15期
作者:黄莎 李凡
自贡市第五人民医院老年科 643020
通信作者:李凡 Email:1538848876@qq.com
摘要
结缔组织病相关间质性肺病(CTD-ILD)发病率高,生存时间明显缩短。早期检测、在疾病过程中动态评估疾病进展、及时给予适当的治疗可以改善CTD-ILD患者的生活质量及预后。一些简单易得的方法可能在疾病早期就检测出结缔组织病患者合并的间质性肺病。为CTD-ILD患者制定治疗方案时,一些特异性较好的预后因素(如性别、年龄等一般情况,肺功能,高分辨率CT,病理类型,复合死亡预测模型等)可能会让治疗更加有针对性。随着新的治疗方法的出现,未来的临床试验可能会提出更好的管理CTD-ILD的方案。本文对近几年CTD-ILD诊断、病情评估及治疗的研究进展作一综述。

目前认为间质性肺病(interstitial lung disease,ILD)与弥漫性实质性肺疾病意义相同,是以肺泡壁为主包括周围组织及其相邻支持结构的一组疾病群[1]。结缔组织病相关间质性肺病(connective tissue disease-associated interstitial lung disease,CTD-ILD)是其常见原因之一,其包括任何合并有明确诊断的结缔组织病或者有一组症状、体征和异常的实验室检查提示是结缔组织病的ILD[2]。常见的CTD-ILD包括类风湿性关节炎相关间质性肺病(rheumatoid arthritis-associated interstitial lung disease,RA-ILD)、特发性炎性肌病相关间质性肺病、原发性干燥综合征相关间质性肺病、系统性硬化症相关间质性肺病(systemic sclerosis-related interstitial lung disease,SSc-ILD)等。中南大学对近10年结缔组织病患者的死亡趋势进行分析,CTD-ILD死亡患者人数占该研究中总结缔组织病死亡患者人数的31.76%,CTD-ILD患者相较于单纯诊断为结缔组织病的患者,其生存时间缩短约2年[3]。有研究显示ILD可引起肺动脉高压,相比不合并ILD的肺动脉高压患者,ILD合并肺动脉高压患者的生存率降低了18%,仅为46%[4]。
CTD-ILD的发病率国内外报告不等,国外研究提示CTD-ILD人数占该研究中ILD总人数的34.8%[5],国内研究显示CTD-ILD人数占该研究中ILD总人数的67%[6]。CTD-ILD患者的临床表现差异很大,有的患者仅在影像学检查时发现异常,并无任何临床症状,有的患者可以从一开始便表现为呼吸衰竭,且快速进展直至死亡。早期检测出ILD并给予及时、适当的治疗可以有效改善CTD-ILD患者的生存质量及预后。本文对CTD-ILD的诊断、病情评估及治疗作一综述。

1 诊断
1.1 临床症状
CTD-ILD的临床症状由于各结缔组织病的不同而有很大差异性,可以从偶然在影像学发现到快速进展导致呼吸衰竭,甚至死亡[2]。患者就诊的常见临床主诉主要包括咳嗽、气短、发热、关节肿痛、晨僵、口眼干、皮疹、肌痛、肌无力、雷诺现象等,全面的病史询问可能有助于早期诊断。
1.2 体征
CTD-ILD患者的体征除结缔组织病各自的体征特点外,Velcro啰音很容易被发现,甚至可以成为CTD-ILD存在的第一线索,因此被认为是早期诊断ILD的关键因素。
1.3 血清学标志物
血清学标志物容易获得,易于纵向追踪,并且有可能在疾病的临床过程中添加重要的诊断和预测信息。有研究结果显示,CTD-ILD患者的KL-6水平显著高于不合并ILD的结缔组织病患者或健康人群(P<0.008,P<0.001)[7]。当CC16高于46 μg/L时,对肺纤维化的诊断敏感性高达52%,特异性高达89%,仅稍逊于KL-6的敏感性及特异性(均为85%)[8]。在系统性硬化症患者中,合并肺纤维化患者的SP-A和SP-D明显高于不合并肺纤维化患者,血清中YKL-40水平的提高提示更差的预后[8]。
1.4 CTD相关自身抗体
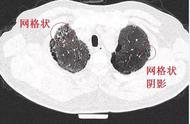
肌炎与抗Jo-1抗体、抗EJ抗体、抗PL-7抗体密切相关,ILD与抗Jo-1抗体、抗EJ抗体、抗PL-7抗体、抗PL-12抗体、抗KS抗体及抗OJ抗体均相关。有研究显示,在发病时证实只存在ILD,但合并抗Jo-1抗体、抗EJ抗体、抗PL-7抗体阳性,那么这部分患者将来极有可能会发展为肌炎。大多数在疾病早期证实不合并ILD,但抗合成酶抗体阳性的患者最终会发展为ILD[9]。在2016年发表的一项研究成果中,诊断为抗合成酶综合征的患者在6个月内被发现合并ILD,诊断为ILD的患者在6个月内被发现合并抗合成酶综合征,在该项研究中,出现这种规律的患者约占该研究中总患者的一半[10]。Chartrand等[11]进行了一项回顾性分析,发现那些最初被诊断为特发性间质性肺病,后来被证实合并抗合成酶综合征或者肌炎等疾病的患者,在疾病过程中大多数都有细微的抗合成酶综合征表现,该研究结果强调了多学科评估的重要性。观察抗合成酶抗体阳性的ILD患者的CT表现,发现其与非特异性间质性肺炎的CT表现类似,以下肺和支气管血管周围为主的磨玻璃影及网格影,有1/3的患者CT表现为合并纤维化的机化性肺炎[12]。2015年发表的一项研究显示对治疗无反应的患者抗CADM-140/MDA5抗体滴度高于存活的患者(P<0.05),该项研究还发现抗CADM-140/MDA5抗体效价和CX3CL1之间的相关性很强(r=0.889 7),提示CX3CL1可能与抗CADM-140/MDA5抗体阳性的无肌病皮肌炎相关间质性肺病患者的发病存在一定联系[13]。在无肌病皮肌炎患者中,抗MDA5抗体阳性与ILD(P=0.04)、快速进展性间质性肺病(P<0.001)以及更低的生存率密切相关(P=0.007)[14]。肺活检时,合并抗MDA5抗体阳性的无肌病皮肌炎相关间质性肺病患者的病理类型多为弥漫性肺泡损伤,但2016年报道了1例病理类型是非特异性间质性肺炎的患者,该患者在1 000 mg甲泼尼龙冲击治疗3 d,并循环2个周期后,序贯给予10 mg泼尼松龙和5 mg他克莫司,该患者症状在1个月内明显改善,铁蛋白降至648 μg/L,用力肺活量占预计值百分比(percentage of forced vital capacity in predicted value,FVC%pred)增加至96%,6分钟步行距离增加至560 m,就诊时这些数值分别是1 269 μg/L、86.5%、285 m,这些改善至观察结束已维持了1年,并且没有重大不良反应。报道这个病例的学者认为这种病理类型的出现一种可能是因为这是疾病早期阶段的肺活检结果,将来还是可能会发展为弥漫性肺泡损伤[15]。对于类风湿性关节炎患者来说,若合并抗瓜氨酸抗体阳性,则提示在疾病早期就可能会出现肺结构的改变[16]。弥漫性硬皮病中抗拓扑异构酶Ⅰ抗体的滴度与ILD的疾病严重程度和活动性相关[17]。
1.5 肺超声
高分辨率CT(high-resolution computed tomography,HRCT)目前是检测ILD的首选方法,其检测方便,敏感性及准确性高,但HRCT价格高昂,且存在一些潜在辐射问题,而CTD-ILD患者在疾病过程中常需反复行HRCT检查。肺功能作为ILD的筛查时敏感性低。肺活检属有创性检查,有一定风险,患者不易接受,所以人们急需一种非侵入性、准确、低价格、无辐射的诊断方式,肺超声检查正好符合这些特点。近年许多学者进行了针对肺超声检测ILD的准确性的研究,许多研究证实肺超声有良好的准确性,且敏感性高,与HRCT结果一致性高,但大部分研究仅在系统性硬化症患者中进行。一项纳入349例患者的荟萃分析显示,肺超声检查的敏感性高达91.5%,特异性高达81.3%,且与HRCT显著相关(r=0.783)[18]。2016年另一项研究结果也显示肺超声检查B线数与HRCT评分呈正相关(r=0.81,P=0.000 1),与DLCO之间存在负相关(r=-0.63,P<0.000 1)[19]。但该项检测手段需有经过专门培训的工作人员,且目前还没有制定一个统一的评分系统来界定ILD。
1.6 微小RNA(microRNA,miRNA)
miRNA是小的非编码RNA分子,其通过抑制蛋白质的翻译来调节大部分基因的表达。2017年发表的一项研究纳入了218例结缔组织病患者,通过定量逆转录PCR检测miR-200c的表达水平,比较不同疾病组的miR-200c水平。结果显示,系统性硬化症组的miR-200c水平显著高于特发性炎性肌病、原发性干燥综合征和类风湿性关节炎组,特发性炎性肌病和原发性干燥综合征组的miR-200c水平明显高于类风湿性关节炎组。合并ILD组miR-200c水平明显高于不合并ILD组,重度ILD组miR-200c水平明显高于轻度ILD组[20]。多项研究表明,miR-26a、miR-326、miR-486-5p等miRNA在纤维化模型中减少,其过量表达均可不同程度地抑制肺纤维化[21]。有学者探究了miR-34a抑制肺纤维化的机制,在研究中发现miR-34a主要在肺成纤维细胞中高表达,这种miRNA增加了衰老相关的β-半乳糖苷酶活性,增强了衰老标志物的表达,并降低了细胞增殖能力,从而抑制肺纤维化反应[22]。
2 病情评估
2.1 一般情况
曾有一项RA-ILD患者的多中心研究,研究显示男性、发病年龄大、吸烟、类风湿因子阳性与ILD的发生独立相关,尤其是男性吸烟患者与ILD的发生强烈相关[23]。同年另一项回顾性分析显示RA-ILD患者的死亡预测因子主要包括老年、男性、DLCO低、纤维化范围广、出现寻常型间质性肺炎(usual interstitial pneumonia,UIP)[24]。
2.2 肺功能
纳入1 616例SSc-ILD患者的一项荟萃分析共包括27项研究,其中多项研究结果显示较低的FVC%pred、DLCO%pred提示死亡风险高[25]。另一项针对RA-ILD患者的研究显示基线FVC%pred较低以及从随访开始的任意时间内FVC%pred下降10%与死亡率增加独立相关[26]。
2.3 HRCT
一项纳入168例CTD-ILD患者的观察性研究结果显示HRCT上牵拉性支气管扩张(HR=1.10,P=0.001,95%CI:1.04~1.17)和蜂窝化的程度(HR=1.08,P=0.021,95%CI:1.03~1.13)是死亡的独立危险因素,且牵拉性支气管扩张的严重程度与死亡率相关系数更高[27]。对SSc-ILD患者来说,HRCT上的病灶范围是预测死亡率、提示ILD进展的唯一变量[25]。
2.4 病理类型
UIP型类风湿关节炎患者存活时间比非特异性间质性肺炎型类风湿关节炎患者短(log rank P=0.02)[26]。曾有学者对RA-ILD的HRCT类型进行研究,结果显示RA-ILD患者最常见的HRCT类型是UIP,且HRCT上显示为UIP或者病灶范围广泛,与全因死亡率增加相关[23]。一项回顾性研究显示结缔组织病患者中UIP型患者的生存时间(平均生存时间为125.5个月)长于特发性肺纤维化患者(平均生存时间为66.9个月)(P=0.001),但UIP型的RA-ILD患者除外[28]。
2.5 复合死亡预测模型
有研究者证实使用基于性别、年龄、肺功能的GAP模型能够准确预测慢性ILD的死亡风险,而试验中改进的ILD-GAP模型能够准确预测慢性ILD亚型和疾病各个阶段的死亡率[29]。另一项研究表明,根据年龄、过去24周因呼吸系统疾病住院史、FVC、过去24周FVC变化、6分钟步行距离和过去24周6分钟步行距离变化计算修正的du Bois指数能够更好地预测SSc-ILD患者的1年死亡率。FVC和6分钟步行距离是SSc-ILD患者1年死亡率的重要独立预测因子[30]。
3 治疗
大致来讲,CTD-ILD的治疗分为一般治疗、诱导治疗、维持治疗及其他治疗4个方面。
3.1 治疗时机
有学者提出,HRCT病灶范围≥20%或FVC%pred<70%时是治疗SSc-ILD的最佳时机[31]。也有人认为,在病情进展时,即DLCO%pred降低大于15%或者FVC%pred下降大于10%时,也应及时开始治疗[32]。
3.2 一般治疗
进行心肺康复锻炼、吸烟者戒烟是CTD-ILD的重要辅助治疗措施。胃食管反流病是CTD-ILD患者,尤其是SSc-ILD患者常见的合并症。有学者提出应对无症状的胃食管反流患者也给予质子泵抑制剂治疗,此外,一般措施如避免进食降低食管下段括约肌张力的食物,少吃多餐,避免在睡前进食,以及抬高床头都是目前提倡的减少胃食管反流症状的措施,必要时可加用促进胃肠动力的药物。CTD-ILD患者合并继发性肺动脉高压明显降低了患者的生存率,慢性缺氧、原发性血管病变以及肺纤维化都是其发生的重要原因[4,33]。提倡对所有CTD-ILD患者进行定期的超声心动图筛查。波生坦靶向治疗ILD患者所引起的继发性肺动脉高压可能是无效的[34]。不仅如此,许多针对肺动脉高压的治疗对由于CTD-ILD引起的继发性肺动脉高压都被证实是无效的。在中南大学发表的关于近10年结缔组织病住院患者的死亡原因及趋势的研究中,感染占总结缔组织病死亡患者的42.94%[3]。2016年一项针对特发性肺纤维化患者住院期间感染病原菌种类的研究显示,发生感染的病原菌依次是流感嗜血杆菌、铜绿假单胞菌、金黄色葡萄球菌以及肺炎克雷伯杆菌,且住院期间肺部感染的严重程度与30 d住院死亡率显著相关[35]。因此,需密切关注患者在治疗过程中有无感染高危因素及感染征象,一旦发现,评估利弊后,应及时给予抗感染治疗。
3.3 诱导治疗
3.3.1 糖皮质激素
糖皮质激素是CTD-ILD患者接受诱导治疗时最重要药物。有研究显示,糖皮质激素可改善CTD-ILD患者肺功能,研究人员将CTD-ILD患者分为2组,治疗组给予糖皮质激素单药或免疫抑制剂治疗,中位随访期是9.8年,结果显示FVC较基线值上升了170.4 ml,而对照组与基线FVC相比则下降了61 ml[36]。糖皮质激素的剂量、给药途径、疗程和减量方案由临床医师根据不同的临床情况决定。2017年一项回顾性研究显示,在维持治疗阶段单用糖皮质激素与疾病的早期复发相关[37]。
3.3.2 环磷酰胺
对于大部分病情严重或快速进展的CTD-ILD患者,环磷酰胺联合糖皮质激素是基本治疗方案。2017年一项包括了2项研究共182例参与者的荟萃分析提示环磷酰胺组与安慰剂组相比FVC%pred平均差值为2.83%(95%CI:0.80~4.87,P=0.006),但是DLCO%pred平均差值为-1.68%(95%CI:-4.37~1.02,P=0.25)。提示相比安慰剂组,环磷酰胺组患者FVC可有较明显改善,但这2项试验显示环磷酰胺组患者发生血尿、白细胞减少、中性粒细胞减少以及恶心的风险增加,并因此导致了更高的停药率。这个荟萃分析同时分析了另外2项研究共149例患者使用环磷酰胺和霉酚酸酯改善肺功能的差异,2组患者肺功能改善差异无统计学意义。环磷酰胺组患者白细胞减少可能性更大,但在生活质量、全因死亡、呼吸困难及咳嗽严重程度方面2组患者差异无统计学意义[5]。
有研究显示CTD-ILD患者接受环磷酰胺治疗后,FVC%pred增加(10.84±13.81)%,未发生重大不良事件[38]。另有一项21例CTD-ILD患者接受口服环磷酰胺治疗,此外,给予低剂量泼尼松(≤10 mg)6个月,12个月后基线和治疗后FVC%pred分别为(59.5±10.7)%和(63.1±16.2)%,FVC%pred平均差值增加(2.9±11.5)%,P=0.19;基线和治疗后DLCO%pred分别为(67.7±27.5)%和(60.0±22.9)%,平均差值为-(8.0±23.7)%,P=0.12[39]。这2项研究均提示环磷酰胺可有效稳定甚至改善CTD-ILD患者的肺功能。在2013年发表的一项回顾性研究中,在46例对糖皮质激素抵抗的特发性炎性肌病相关间质性肺病患者中,24例接受口服环磷酰胺治疗。6个月时,FVC%pred差值为8.0%,DLCO%pred差值为5.0%,泼尼松剂量从40 mg/d减至10 mg/d[40]。另有研究显示,在多因素分析试验中,若患者对环磷酰胺反应性欠佳,则预示肺功能会逐渐恶化[41]。
由于骨髓抑制、增加感染风险、增加恶性肿瘤发生率等原因,环磷酰胺在CTD-ILD患者中的应用受到一定限制。一般情况下,只有在病情重或病情进展迅速的CTD-ILD患者中才开始加用环磷酰胺,一般建议静脉给药。
3.4 维持治疗
诱导治疗结束,便可开始维持治疗。维持治疗药物主要是临床研究显示患者对其耐受性较好的药物,如硫唑嘌呤、霉酚酸酯、他克莫司。
3.4.1 硫唑嘌呤
硫唑嘌呤常用作CTD-ILD患者的维持治疗阶段。2016年发表了一项研究,在该项研究中,CTD-ILD患者接受环磷酰胺联合小剂量糖皮质激素治疗6个月之后继续接受硫唑嘌呤治疗,1年后FVC及6分钟步行距离均显著改善(P=0.003,P=0.002 8)[42]。2014年发表的一项研究中,15例患者接受硫唑嘌呤和低剂量泼尼松治疗6个月,12个月后基线和治疗后FVC%pred分别为(62.8±9.8)%和(71.1±20.9)%,平均FVC%pred差值增加(7.6±13.1)%,P=0.05;基线和治疗后DLCO%pred分别为(61.4±25.8)%和(76.7±24.0)%,平均差值增加(15.0±14.5)%,P=0.01[39]。2015年一项研究显示硫唑嘌呤被应用于对环磷酰胺诱导治疗效果较好的维持治疗方案中[41]。一般来说,硫唑嘌呤是一种耐受良好的治疗药物,在诱导治疗结束后用硫唑嘌呤进行维持治疗可有效维持肺功能的稳定。
3.4.2 霉酚酸酯
CTD-ILD的治疗方案中加入霉酚酸酯在目前越来越受到临床一线医师的欢迎。2017年一项研究提出霉酚酸酯可能是通过修饰细胞因子或生长因子蛋白表达而对ILD患者有益[43]。2017年一项回顾性研究中,46例SSc-ILD患者接受至少1年的霉酚酸酯治疗(大多数为2 g/d),在6、12、24个月时评估FVC%pred的变化,结果显示与基线相比,6、12、24个月时FVC%pred变化分别为1.01%、2.06%、-0.07%。在这项研究中,患者对霉酚酸酯耐受良好,而且即使给予低至2 g/d的剂量时,也可以减缓SSc-ILD患者肺功能的下降速度[44]。2016年一项单中心回顾性分析中,34例SSc-ILD患者接受霉酚酸酯治疗,治疗6个月后FVC%pred增加(6.07±11.92)%。在该项研究中未发生重大不良事件。该研究提示霉酚酸酯可有效地稳定SSc-ILD患者的肺功能[38]。2016年发表的一项队列研究中,共有22例SSc-ILD患者接受霉酚酸酯治疗,在治疗前12个月,FVC的中位绝对值为2.50 L,在治疗开始时下降到2.12 L(P=0.02),开始治疗后12个月时,FVC的中位绝对值为2.13 L(P=0.86),开始治疗后24个月时为2.17 L(P=0.65),开始治疗后36个月时为2.25 L(P=0.78)。因不良反应早期停药的只有4例,主要原因是胃肠道并发症。该项研究提示霉酚酸酯可以较好较长时间地稳定SSc-ILD患者的肺功能,且患者对其耐受性良好[45]。将霉酚酸酯用于CTD-ILD的最大研究是一个包括125例CTD-ILD患者的队列,其平均年龄是(60.4±11.6)岁;大多数患者给予3 g/d的霉酚酸酯治疗,试验结果显示霉酚酸酯可以有效减少患者口服糖皮质激素的剂量,该项研究也提示霉酚酸酯与FVC和DLCO的改善有关,且耐受性良好[46]。
3.4.3 他克莫司
有研究人员将49例CTD-ILD患者分为2组,一组接受传统治疗,即高剂量泼尼松龙(0.8~1.0 mg·kg-1·d-1)加环磷酰胺(500 mg/m2,每月1次),另一组同时接受他克莫司和传统治疗,治疗结束后,研究人员发现他克莫司组患者的无病及无事件生存期都比传统治疗组显著延长[47]。2016年发表的一项研究中,CTD-ILD患者(共17例)在接受传统治疗时加用他克莫司,治疗结束后观察FVC%pred增加了(7.4%±12.5)%(P=0.06),DLCO%pred增加了(10.0±17.0)%(P=0.02),泼尼松用量减少了(20.3±25.2) mg(P=0.02),在该项研究中,他克莫司组患者没有因为他克莫司的应用而发生危及生命的不良反应事件。该研究也提示他克莫司作为辅助治疗是有效的,同时在治疗过程中可有效减少激素的用量,且患者对该药物耐受性良好[48]。2016年发表的另一项研究显示早期给予他克莫司治疗组的死亡率明显低于延迟治疗组(P=0.009)[49]。曾有学者写了一篇关于难治性皮肌炎/多发性肌炎患者接受他克莫司治疗的综述,该综述搜索了Cochrane、PubMed、Embase以及中国知网在1980年5月至2015年4月关于他克莫司治疗皮肌炎/多发性肌炎的文章,共计107篇,其中8项研究符合纳入标准,共计134例患者,其中有65例患者合并ILD,治疗结束后,89.3%的患者FVC改善或者稳定,81.3%的患者DLCO改善或者稳定[50]。该综述提示对于某些CTD-ILD患者,他克莫司可能是一个选择。2017年一项回顾性研究显示他克莫司可有效减少抗合成酶抗体阳性的CTD-ILD患者的复发率[37]。
3.5 其他治疗
3.5.1 生物制剂
利妥昔单抗对部分病情严重或病情快速进展的CTD-ILD患者可能是有效的。2017年4月发表的一项研究中,44例CTD-ILD患者在应用利妥昔单抗之前6~12个月,FVC%pred中位数下降了2.4%,DLCO%pred中位数下降了4.4%,在利妥昔单抗治疗后6~12个月,FVC%pred中位数升高了1.2%,DLCO%pred中位数下降了1.3%[51]。曾有研究纳入了50例病情严重且呈进行性进展的ILD患者,让其全部接受利妥昔单抗治疗,其中33例为CTD-ILD,在利妥昔单抗给药前6~12个月,中位FVC%pred下降了14.3%,中位DLCO%pred下降了18.8%,给予利妥昔单抗治疗后,FVC%pred中位数改善了6.7%(P<0.01),DLCO%pred中位数稳定。该研究显示对于病情严重、病情进展迅速的ILD患者,利妥昔单抗治疗也是应该考虑的药物[52]。除此之外,2017年发表的一项纳入14例CTD-ILD患者应用利妥昔单抗的回顾性研究,该研究显示利妥昔单抗可以有效稳定患者的肺功能、HRCT表现及Rodnan皮肤评分[53]。同年发表了一项个案报道,1例21岁的女性CTD-ILD患者由于环磷酰胺可导致不可逆的闭经而坚决拒绝环磷酰胺治疗,临床医师给予她泼尼松龙联合环孢素A治疗后症状明显加重,FVC%pred及DLCO%pred分别降至49%和31%,给予利妥昔单抗治疗24个月后FVC%pred及DLCO%pred分别上升了22%和17%,且在治疗过程中,未发现药物不良反应[54]。虽然这只是一个个案报道,但却明显显示了利妥昔单抗对难治性CTD-ILD患者的有效性和安全性。2017年7月发表的一项比较利妥昔单抗和肿瘤坏死因子抑制剂作为CTD-ILD患者生物学治疗的死亡率的研究,该研究提示接受利妥昔单抗治疗与接受肿瘤坏死因子抑制剂治疗相比,前者死亡率更低[55]。呼吸道感染是利妥昔单抗治疗CTD-ILD患者时最常见的不良反应事件[56]。
3.5.2 抗纤维化药物
目前还没有针对吡非尼酮和尼达尼布这2种药物在CTD-ILD患者治疗中的相关大型研究。2014年发表的一项研究中,5例CTD-ILD患者接受吡非尼酮治疗后,肺功能都明显改善[39]。2017年报道了1例患有局限性系统性硬化症患者在给予几种免疫抑制剂治疗后肺纤维化仍进行性加重,但给予尼达尼布后患者肺功能和临床症状开始稳定的个案报道[57]。
3.5.3 肺移植
对于复发及严重病例,可以考虑肺移植,肺移植是CTD-ILD治疗的最后手段。2017年发表了关于CTD-ILD患者肺移植并发症的研究,这项研究纳入了11例患者,其中6例死亡,原因分别是早期移植物排斥反应、肺栓塞、感染性休克、心力衰竭、严重原发性移植失败,另外5例在后续随访过程中未发现急慢性排斥反应及其他并发症,该项研究还显示CTD-ILD患者进行肺移植后的生存率与其他疾病进行肺移植的生存率相比并无明显下降[58]。因此,对于某些CTD-ILD患者,肺移植是相对安全的,在疾病后期应该考虑在内。2016年一项研究显示接受单侧肺移植或者分2个阶段的双侧肺移植的患者相对于一次性进行双侧肺移植的患者来说,肾损伤的发生率更低,这提示肺移植手术方案对肺移植患者的生存率可能也是有影响的[59]。
3.6 治疗总结
糖皮质激素同时给予免疫抑制剂是CTD-ILD治疗的主要方法,但主要用于病情严重或病情快速进展的患者。生物制剂、抗纤维化药物及肺移植对于病情严重、进展迅速的患者可能是有效的。一般治疗措施(例如吸氧、戒烟和心肺康复锻炼)以及治疗合并症或加重因素(如胃食管反流病、继发性肺动脉高压、感染)应同时考虑在CTD-ILD治疗计划中,成为综合治疗的一个方面。
4 总结
新的自身抗体、血清生物标志物的探索以及影像学方面的进步将使CTD-ILD的诊断方法变得更加丰富,也更加灵敏,对预后的评估或许也可以更加准确、简单。大型的、多中心的、设计良好的国际临床试验有助于为各种类型CTD-ILD提供更好的治疗方案。
利益冲突所有作者均声明不存在利益冲突
参考文献略
,